题目内容
【题目】水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+4OH- = Fe3O4↓+S4O62-+2H2O。下列说法不正确的是
A. 参加反应的氧化剂与还原剂的物质的量之比为1∶5
B. 若有2 mol Fe2+被氧化,则被Fe2+还原的O2的物质的量为0.5 mol
C. 每生成1 mol Fe3O4,反应转移的电子为4 mol
D. O2是氧化剂,S2O32-与Fe2+是还原剂
【答案】A
【解析】
试题在3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,化合物中铁元素、硫元素用平均化合价,铁元素的化合价变化![]() 硫元素的化合价变化为
硫元素的化合价变化为![]() 氧元素的化合价变化:0→-2,所以氧化剂是O2;还原剂是Fe2+、S2O32-.氧化剂是O2,还原剂是Fe2+、S2O32-,3molFe2+参加反应时只有2mol被氧化,参加反应的氧化剂与还原剂的物质的最之比为1:(2+2)=1:4,,故A错;2molFe2+被氧化时,失去电子2mol,则被Fe2+还原的O2的物质的量为
氧元素的化合价变化:0→-2,所以氧化剂是O2;还原剂是Fe2+、S2O32-.氧化剂是O2,还原剂是Fe2+、S2O32-,3molFe2+参加反应时只有2mol被氧化,参加反应的氧化剂与还原剂的物质的最之比为1:(2+2)=1:4,,故A错;2molFe2+被氧化时,失去电子2mol,则被Fe2+还原的O2的物质的量为![]() B正确;每生成1molFe3O4,参加反应的氧气为1mol,转移电子数为1mol×4=4mol,故C正确;O2是氧化剂,S2O32-和Fe2+是还原剂,故D正确;所以答案选A
B正确;每生成1molFe3O4,参加反应的氧气为1mol,转移电子数为1mol×4=4mol,故C正确;O2是氧化剂,S2O32-和Fe2+是还原剂,故D正确;所以答案选A

 阅读快车系列答案
阅读快车系列答案【题目】某学习小组为探究镁及其化合物的性质,查阅资料知:
ⅰ | Mg3N2遇水发生水解反应 |
ⅱ | 2NO2+2NaOH=NaNO2+NaNO3+H2O NO2+NO+2NaOH=2NaNO2+H2O |
ⅲ | 常溫下,NH3·H2O、CH3COOH的电离常数均为1.8×10-5 |
I.探究镁的性质。
为探究镁与二氧化氮反应的产物,设计如图所示实验装置。
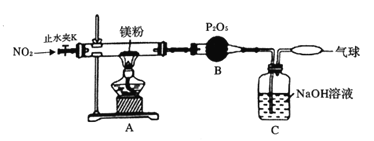
(1)简述检查该装置气密性的方法________;B装置的作用是___________.
(2)实验时,当A装置中充满红棕色气体时点燃酒精灯,这样操作的目的是_______。
(3)确定有N2生成的实验现象是__________。
(4)实验完毕,为确认产物中有Mg3N2,取少量A中固体于试管中,滴加蒸馏水,_______,则产物中有氮化镁。
(5)经测定,Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等。
请写出A中发生反应的化学方程式:___________________
Ⅱ.探究Mg(OH)2在氯化铵溶液中溶解的原因。
供选试剂有:氢氧化镁、蒸馏水、硝酸铵溶液、盐酸、醋酸铵溶液。
取少量氢氧化镁粉末于试管中,向其中加人足量饱和氯化氨溶液,振荡,白色粉末全部溶解。为了探究其原因,他们依据Mg(OH)2(s)==Mg2+(aq)+2OH-(aq)提出两种假设。
假设1:氯化铵溶液呈酸性,H++OH-=H2O,促进Mg(OH)2溶解;
假设2:NH4++OH-=NH3·H2O,促进Mg(OH)2溶解。
(6)请你帮他们设计实验验证哪一种假设正确:____________.