题目内容
【题目】气体在化学变化中被还原的是
A. CO2使Na2O2固体变白 B. Cl2使KI-淀粉试纸变蓝
C. C2H4使Br2的CCl4溶液褪色 D. H2S使酸性KMnO4溶液褪色
【答案】B
【解析】二氧化碳使![]() 固体变白,发生反应
固体变白,发生反应![]() ,
,![]() 的化合价没有发生改变,过氧化钠既是氧化剂,也是还原剂,A错误;氯气把KI溶液中的碘离子氧化为碘单质,碘单质与淀粉相遇溶液变蓝,氯气在反应中做氧化剂,化合价降低,发生还原反应,B正确;乙烯使
的化合价没有发生改变,过氧化钠既是氧化剂,也是还原剂,A错误;氯气把KI溶液中的碘离子氧化为碘单质,碘单质与淀粉相遇溶液变蓝,氯气在反应中做氧化剂,化合价降低,发生还原反应,B正确;乙烯使![]() 的四氯化碳溶液褪色,是乙烯与溴发生了加成反应,
的四氯化碳溶液褪色,是乙烯与溴发生了加成反应,![]() 元素化合价降低,
元素化合价降低,![]() 被还原,乙烯被氧化,C错误;H2S具有强的还原性,能够被酸性KMnO4溶液氧化,高锰酸钾溶液被还原而褪色,体现了硫化氢气体的还原性,D错误;正确选项B。
被还原,乙烯被氧化,C错误;H2S具有强的还原性,能够被酸性KMnO4溶液氧化,高锰酸钾溶液被还原而褪色,体现了硫化氢气体的还原性,D错误;正确选项B。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案【题目】某学习小组为探究镁及其化合物的性质,查阅资料知:
ⅰ | Mg3N2遇水发生水解反应 |
ⅱ | 2NO2+2NaOH=NaNO2+NaNO3+H2O NO2+NO+2NaOH=2NaNO2+H2O |
ⅲ | 常溫下,NH3·H2O、CH3COOH的电离常数均为1.8×10-5 |
I.探究镁的性质。
为探究镁与二氧化氮反应的产物,设计如图所示实验装置。
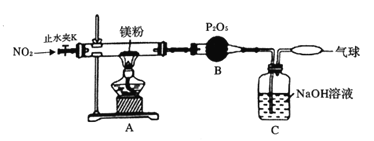
(1)简述检查该装置气密性的方法________;B装置的作用是___________.
(2)实验时,当A装置中充满红棕色气体时点燃酒精灯,这样操作的目的是_______。
(3)确定有N2生成的实验现象是__________。
(4)实验完毕,为确认产物中有Mg3N2,取少量A中固体于试管中,滴加蒸馏水,_______,则产物中有氮化镁。
(5)经测定,Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等。
请写出A中发生反应的化学方程式:___________________
Ⅱ.探究Mg(OH)2在氯化铵溶液中溶解的原因。
供选试剂有:氢氧化镁、蒸馏水、硝酸铵溶液、盐酸、醋酸铵溶液。
取少量氢氧化镁粉末于试管中,向其中加人足量饱和氯化氨溶液,振荡,白色粉末全部溶解。为了探究其原因,他们依据Mg(OH)2(s)==Mg2+(aq)+2OH-(aq)提出两种假设。
假设1:氯化铵溶液呈酸性,H++OH-=H2O,促进Mg(OH)2溶解;
假设2:NH4++OH-=NH3·H2O,促进Mg(OH)2溶解。
(6)请你帮他们设计实验验证哪一种假设正确:____________.
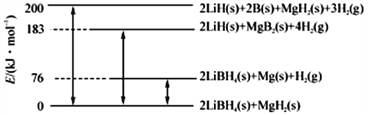
【题目】Ⅰ.开发新能源,新材料是实现社会可持续发展的需要。下图是LiBH4/MgH2体系放氢的焓变示意图,则Mg(s)+2B(s)==MgB2(s)的ΔH=_________kJ·mol-1。
Ⅱ.在1.0L恒容密闭容器中放入0.10mol A(g),在一定温度时进行如下反应:A(g)==2B(g)+C(g)+D(S) ΔH=+85.1kJ·mol-1。
容器内气体总压强P与起始压强P0的比值随反应时间变化数据见下表:
时间t/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
P/P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题:
(1)下列能提高A的转化率的是______________。
A.升高温度 B.向体系中通入气体A
C. 减少D的物质的量 D.向体系中通入稀有气体
(2)下列说法能表明该反应达到化学平衡状态的是_______________。
A.A、B、C的物质的量之比为1∶2∶1 B.单位时间内生成2n mol B,同时生成n mol C
C.容器中气体的密度不变 D.容器中气体的平均摩尔质量不变
(3)达到平衡状态时A的转化率是________(结果保留两位有效数字)。
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则D的取值范围为n(D)_______ mol。
(5)相同条件下,若将容器改为恒压容器,进行上述反应,某时刻,A的转化率为75%,则此时B的物质的量浓度为______________mol/L。
