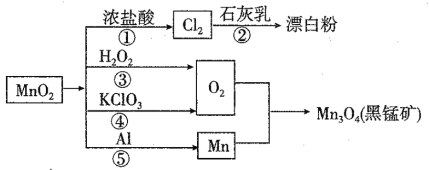
��Ŀ����
����Ŀ�����н�������A��B��C������ס����Լ�����D��E��F��G��H������֮����ת����ϵ����ͼ��ʾ��ͼ����Щ��Ӧ��������ͷ�Ӧ������û�б������
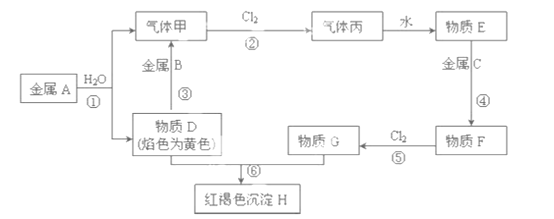
��ش��������⣺
��1������B�Ļ�ѧʽΪ��_____________________��
��2���������Cl2��ȼ�յ�����___________________________��
��3������A��G��ˮ��Һ��Ӧ�Ļ�ѧ����ʽ��_____________________��
��4��д�����з�Ӧ�����ӷ���ʽ��
����______________________________________��
����_______________________________________��
��5����Na2O2Ͷ�뵽F��Һ�У����Թ۲쵽�������ǣ�______________��
���𰸡�Al �в�ɫ���棬ƿ���а��� 6Na+2FeCl3+6H2O��2Fe��OH��3��+6NaCl+3H2�� 2OH��+2H2O+2Al��2AlO2��+3H2�� Cl2+2Fe2+��2Fe3++2Cl�� ���ɺ��ɫ����������ɫ�������
��������
����A��ˮ��Ӧ�������������D��D����ɫ��ӦΪ��ɫ֤��AΪNa�����ΪH2��DΪNaOH������B������������Һ��Ӧ����������˵��BΪAl�������������Ӧ���ɱ�ΪHCl������EΪ������Һ������D�������ƣ�D������GΪ��Ӧ���ɺ��ɫ����HΪFe(OH)3��GΪFeCl3���ƶ�����FΪFeCl2����CΪFe���ݴ˴��⡣
�������Ϸ�����֪A��Na��B��Al��C��Fe��D��NaOH��E�����ᣬF��FeCl2��G��FeCl3��H��Fe(OH)3������H2������HCl����
��1������B��������ѧʽΪAl��
��2��������Cl2��ȼ�������Ȼ��⣬������Ϊ�в�ɫ���棬ƿ���а�����
��3�������Ƽ�����ˮ��Ӧ�����������ƺ����������ɵ��������������Ȼ�����Ӧ�������Ȼ�����Һ��Ӧ�Ļ�ѧ����ʽ6Na+2FeCl3+6H2O��2Fe(OH)3��+6NaCl+3H2����
��4��д�����з�Ӧ�����ӷ���ʽ��
����Al��NaOH��Һ������Ӧ����ƫ�����ƺ���������Ӧ�����ӷ���ʽ��2OH����2H2O��2Al��2AlO2����3H2����
�������������Ȼ����������Ȼ��������ӷ���ʽΪCl2+2Fe2+��2Fe3++2Cl����
��5���������ƾ���ǿ�����ԣ�����ˮ��ˮ��Ӧ�����������ƺ���������Na2O2Ͷ�뵽�Ȼ�������Һ�У����Թ۲쵽�����������ɺ��ɫ����������ɫ���������