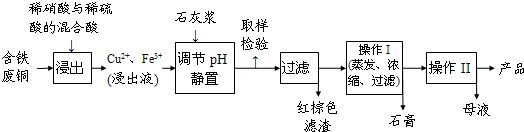
��Ŀ����
��10�֣��ش��������⣺
��1����ӦA(g)+B(g)![]() C(g)+D(g)�����е������仯����ͼ��ʾ���жϸ÷�Ӧ��H 0�����������������
C(g)+D(g)�����е������仯����ͼ��ʾ���жϸ÷�Ӧ��H 0�����������������
����ȷ��������
��2����Al2O3��Ni������̬���ᷢ�����з�Ӧ��
����(g)= CO (g)+ H2O (g)�� ��H1= +34.0 kJ/mol
����(g)= CO2 (g)+ H2(g) ��H2= ��7.0kJ/mol
�����ķ���ʽΪ ���ڸ������£���̬CO2����̬H2��Ӧ������̬CO����̬H2O���Ȼ�ѧ����ʽΪ ��
��3����ͼ��ʾ��ˮ�����Թ�����һö��������������۲죺
I���Թ���Һ����������������Ӧ�� ��
II���Թ���Һ���½������� ��ʴ��
III����Һ��Ϊˮ����Һ��Ϊ��ˮ���������� ����ס����ҡ�����Һ�и�ʴ���ٶȿ졣
��10�֣���1��������1�֣�
��2��CH2O2��1�֣���CO2(g) + H2(g) =CO(g) + H2O(g) ��H = +41.0kJ/mol����2�֣�
��3��I O2 + 2H2O+ 4e-�� 4OH- ����2�֣�II���⡣��2�֣�III�ҡ���2�֣�
����:��

��ϰ��ϵ�д�
 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д�
�����Ŀ
 ��һ��ҽҩ�м��壬�������Ʊ�����Ѫҩ����ͨ������·�ߺϳ�
��һ��ҽҩ�м��壬�������Ʊ�����Ѫҩ����ͨ������·�ߺϳ�


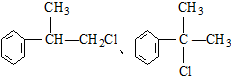
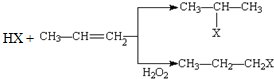 ��XΪ±��ԭ�ӣ�
��XΪ±��ԭ�ӣ�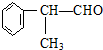 �����ʣ���������һ�����ϣ�
�����ʣ���������һ�����ϣ�