题目内容
5.可逆反应2NO2?2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是 ( )①单位时间内生成n mol O2 的同时生成2n mol NO2
②用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态
③混合气体的颜色不再改变的状态
④混合气体的密度不再改变的状态.
| A. | ①③ | B. | ②③④ | C. | ②③ | D. | ①④ |
分析 平衡状态的两个重要特征上判断:(1)v(正)=v(逆),(2)混合物中各组成成分的百分含量不变,据此分析.
解答 解:此题列出了判断可逆反应是否达到平衡状态的各种可能情况,应从平衡状态的两个重要特征上判断(1)v(正)=v(逆),(2)混合物中各组成成分的百分含量不变.
①符单位时间内生成n mol O2的同时生成2n mol NO2,说明正逆反应速率相等,反应达到平衡状态,故正确;
②反应速率之比始终等于化学计量数之比,所以用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态不一定是平衡状态,故错误;
③NO2是红棕色气体,颜色不变时说明NO2的浓度保持不变,符合特征(2),故正确;
④中是恒容条件,则ρ始终不变,不能说明平衡状态,故错误;
故选A.
点评 本题考查化学平衡状态的判断,难度不大,做题时注意分析化学方程式的前后计量数大小的关系.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
13.人们在生产和生活中认识到,几乎在所有的化学变化过程中都伴随着能量变化,例如放热、吸热、发光、放电等等.如果从能量变化的角度来认识,下面说法中正确的是( )
| A. | 化学变化都是吸热的 | |
| B. | 化学变化都是放热的 | |
| C. | 化学反应前后反应物和生成物所含能量会发生变化 | |
| D. | 反应物所含能量等于生成物所含能量 |
20.如表所示的五种元素中,X、Y、Z、W为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法不正确的是( )
| X | Y | ||
| T | Z | W |
| A. | X、Y两种元素最低价氢化物的稳定性后者大 | |
| B. | Z、W 元素最高价氧化物对应的水化物酸性后者强 | |
| C. | X与Z形成的晶体类型为分子晶体 | |
| D. | T分别与X、Y、W 形成的化合物均具有熔点高,硬度大的特性 |
10.草酸钴用途广泛,可用于指示剂和催化剂制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如图1:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原(填离子符号).
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因:R3++3H2O?R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀.
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.
滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因:R3++3H2O?R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀.
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.
滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.

8. 化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图.关于A的下列说法中,正确的是( )
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图.关于A的下列说法中,正确的是( )
 化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图.关于A的下列说法中,正确的是( )
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图.关于A的下列说法中,正确的是( )| A. | A分子属于酯类化合物,在一定条件下不能发生水解反应 | |
| B. | A在一定条件下可与4 mol H2发生加成反应 | |
| C. | 符合题中A分子结构特征的有机物只有1种 | |
| D. | 与A属于同类化合物的同分异构体只有2种 |
 ,乙炔的电子式为
,乙炔的电子式为
 的名称是3,3,4-三甲基己烷;
的名称是3,3,4-三甲基己烷; CH2=CH-CO18OCH2CH3+H2O.
CH2=CH-CO18OCH2CH3+H2O.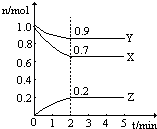 在一定条件下,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
在一定条件下,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
 .
.
 .
. .
. .
.