题目内容
下列(1)至(4)因果关系题,每题均由论断与理由两部分组成,请用相关要求的A、B、C、D序号作答.
|
|
A |
B |
C |
D |
|
论断 |
正确 |
正确 |
错误 |
错误 |
|
理由 |
正确 |
错误 |
正确 |
错误 |
(1)论断:具有n个电子层的原子,核外电子数必等于![]() 个
个
理由:原子核外各电子层最多可容纳![]() 个电子
个电子
答案______________________________.
(2)论断:氯元素的相对原子质量为35.5
理由:自然界中![]() 和
和![]() 的质量分数分别25%和75%
的质量分数分别25%和75%
答案_____________________________.
(3)论断:同种元素的原子其质量数不一定相同
理由:元素的种类由原子核内质子数决定,不受中子数影响
答案_____________________________.
(4)论断:同种元素的原子一定相同
理由:不同种原子一定属于不同元素
答案_____________________________.
答案:C;B;A;D
提示:
提示:
(1)理由陈述是对的,但n个电子层的原子,核外电子不一定等于 (2)自然界中 (3) 论断和理由均正确,同位素之间质量数不同,但决定元素种类的是其质子数; (4)由上题可知均错.
|

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目

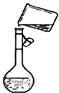 某同学用胆矾晶体(CuSO4?5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题
某同学用胆矾晶体(CuSO4?5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题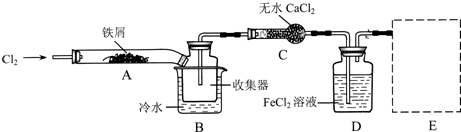
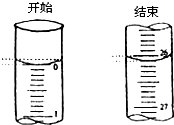 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白: