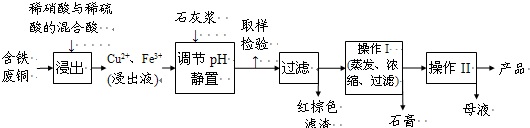
题目内容
 某同学用胆矾晶体(CuSO4?5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题
某同学用胆矾晶体(CuSO4?5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题(1)现有仪器:托盘天平、药匙、烧杯、胶头滴管,还需要哪些玻璃仪器才能完成该实验?请写出
250mL容量瓶、玻璃棒
250mL容量瓶、玻璃棒
.(2)请写出该实验简要的实验步骤:
①计算 ②称量胆矾
25.0
25.0
g ③溶解 ④转移 ⑤洗涤并转移⑥定容 ⑦摇匀(3)如图是该同学转移溶液的示意图,图中的错误是
转移溶液时不能直接倾倒,应用玻璃棒引流
转移溶液时不能直接倾倒,应用玻璃棒引流
.(4)该同学在定容后,加盖倒转摇匀,发现液面低于刻度线,又滴加蒸馏水至刻度.则该同学配得的溶液浓度
偏低
偏低
(填“偏高”、“偏低”或“准确”).(5)一瓶配制好的稀CuSO4溶液,因时间过长,标签污损,为检验它就是盛有CuSO4溶液,说说你的实验检验方法.
| 鉴别对象 | 所选试剂 | 反应的离子方程式 |
| Cu2+ | NaOH溶液 NaOH溶液 |
Cu2++2OH-=Cu(OH)2↓ Cu2++2OH-=Cu(OH)2↓ |
| SO42- | 稀盐酸,BaCl2溶液 稀盐酸,BaCl2溶液 |
Ba2++SO42-=BaSO4↓ Ba2++SO42-=BaSO4↓ |
分析:(1)溶液配制的一般操作步骤有:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,根据配制溶液的实验操作过程选择所需的仪器;
(2)实验室没有240mL容量瓶,选择250mL容量瓶.利用n=cv计算出硫酸铜的物质的量,根据铜离子守恒可知硫酸铜与硫酸铜晶体的物质的量相等,再根据m=nM计算所需硫酸铜晶体的质量;
(3)转移溶液时不能直接倾倒,应用玻璃棒引流;
(4)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
分析判断.
(5)利用铜离子与碱反应生成氢氧化铜蓝色沉淀检验铜离子;
利用硫酸根与钡离子生成不溶于酸的硫酸钡白色沉淀检验硫酸根离子.
(2)实验室没有240mL容量瓶,选择250mL容量瓶.利用n=cv计算出硫酸铜的物质的量,根据铜离子守恒可知硫酸铜与硫酸铜晶体的物质的量相等,再根据m=nM计算所需硫酸铜晶体的质量;
(3)转移溶液时不能直接倾倒,应用玻璃棒引流;
(4)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
| n |
| V |
(5)利用铜离子与碱反应生成氢氧化铜蓝色沉淀检验铜离子;
利用硫酸根与钡离子生成不溶于酸的硫酸钡白色沉淀检验硫酸根离子.
解答:解:(1)实验室没有240mL容量瓶,选择250mL容量瓶.
溶液配制一般步骤是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,
所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
故还需要的玻璃仪器有:250mL容量瓶、玻璃棒,
故答案为:250mL容量瓶、玻璃棒;
(2)实验室没有240mL容量瓶,选择250mL容量瓶.需硫酸铜晶体的质量为m=0.25L×0.40mol?L-1×250g/mol=25.0g,
故答案为:25.0;
(3)转移溶液时不能直接倾倒,应用玻璃棒引流,
故答案为:转移溶液时不能直接倾倒,应用玻璃棒引流;
(4)加盖倒转摇匀,少量溶液残留在瓶口与瓶塞之间,再滴加蒸馏水至刻度线,溶液的浓度偏大,所配溶液的浓度偏低,
故答案为:偏低;
(5)区溶液少许,加入氢氧化钠溶液,有蓝色絮状沉淀生成,说明含有铜离子,反应离子方程式为Cu2++2OH-=Cu(OH)2↓;
取少许溶液,加入稀盐酸,BaCl2溶液,有白色沉淀生成,说明含有硫酸根离子,反应离子方程式为:Ba2++SO42-=BaSO4↓,
故答案为:
.
溶液配制一般步骤是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,
所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
故还需要的玻璃仪器有:250mL容量瓶、玻璃棒,
故答案为:250mL容量瓶、玻璃棒;
(2)实验室没有240mL容量瓶,选择250mL容量瓶.需硫酸铜晶体的质量为m=0.25L×0.40mol?L-1×250g/mol=25.0g,
故答案为:25.0;
(3)转移溶液时不能直接倾倒,应用玻璃棒引流,
故答案为:转移溶液时不能直接倾倒,应用玻璃棒引流;
(4)加盖倒转摇匀,少量溶液残留在瓶口与瓶塞之间,再滴加蒸馏水至刻度线,溶液的浓度偏大,所配溶液的浓度偏低,
故答案为:偏低;
(5)区溶液少许,加入氢氧化钠溶液,有蓝色絮状沉淀生成,说明含有铜离子,反应离子方程式为Cu2++2OH-=Cu(OH)2↓;
取少许溶液,加入稀盐酸,BaCl2溶液,有白色沉淀生成,说明含有硫酸根离子,反应离子方程式为:Ba2++SO42-=BaSO4↓,
故答案为:
| Cu2+ | NaOH溶液 | Cu2++2OH-=Cu(OH)2↓ |
| SO42- | 稀盐酸,BaCl2溶液 | Ba2++SO42-=BaSO4↓ |
点评:本题考查一定物质的量浓度溶液的配制、离子检验等,难度不大,注意根据c=
理解溶液配制原理与误差分析.
| n |
| V |

练习册系列答案
相关题目