题目内容
【题目】铜粉放入稀硫酸溶液中,加热后无明显变化,但加入下列某种盐后铜粉逐渐溶解,这种盐是( )
A. NaCl B. KNO3 C. K2SO4 D. Na2CO3
【答案】B
【解析】试题分析:铜粉溶解是因为铜变成了铜离子,在放入盐之前加热无明显现象发生主要是稀硫酸的氧化性不强,加入这种盐后能能增加溶液的氧化性,而硝酸盐在酸性条件下,有很强的氧化性,离子方程式应该是:8H++2NO3-+3Cu=3Cu2++4H2O+2NO↑,答案选B。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
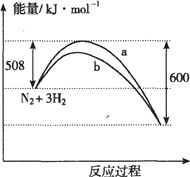
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】已知:N2(g)+3H2(g)===2NH3(g) △H=-92kJ/mol。起始反应物为![]() 和
和![]() ,物质的量之比为1:3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中
,物质的量之比为1:3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中![]() 的物质的量分数如下表:
的物质的量分数如下表:
温度 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A. 体系中![]() 的物质的量分数越大,则正反应速率越大
的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时, ![]() 和
和![]() 的转化率均为1
的转化率均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成![]() 的物质的量最多
的物质的量最多
【题目】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾大晶体,具体流程如下:

已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
请回答:
(1)步骤Ⅰ中的化学方程式_________;步骤Ⅱ中生成Al(OH)3的离子方程式___________。
(2)步骤Ⅲ,下列操作合理的是____________。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅳ,选出在培养规则明矾大晶体过程中合理的操作并排序_______________。
①迅速降至室温 ②用玻璃棒摩擦器壁 ③配制90℃的明矾饱和溶液 ④自然冷却至室温 ⑤选规则明矾小晶体并悬挂在溶液中央 ⑥配制高于室温10-20℃的明矾饱和溶液
(4)由溶液A制备AlCl3·6H2O的装置如下图:

①通入HCl的作用是抑制AlCl3水解和________________________。
②步骤Ⅴ,抽滤时,用玻璃纤维替代滤纸的理由是_____;洗涤时,合适的洗涤剂是_____。
③步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是______________。