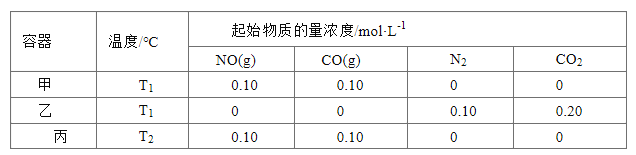
题目内容
【题目】甲醇是一种重要的可再生资源。
(1)已知:2CH4(g)+O2(g) =2CO(g)+4H2(g) △H=akJmol-1
CO(g) +2H2(g)=CH3OH(g) △H=bkJmol-1
写出由CH4和O2制取CH3OH(g)的热化学方程式:____________________________。
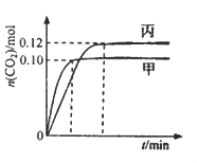
(2)反应:CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K的表达式为________________;甲图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线。从反应开始至达到平衡时,用H2表示的反应速率υ(H2)=________________。
CH3OH(g)的平衡常数K的表达式为________________;甲图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线。从反应开始至达到平衡时,用H2表示的反应速率υ(H2)=________________。
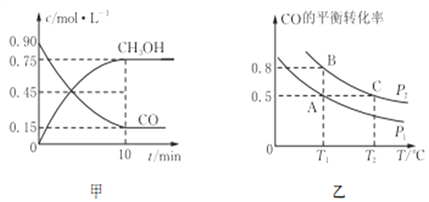
(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,发生反应并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图乙所示。
①能判断该反应达到化学平衡状态的是_______(填选项字母)。
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
②比较A、B两点压强大小P(A)________P(B)(填“>、<、=”)。
③比较KA、KB、KC的大小:________________。
(4)以甲醇为燃料,O2为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。若KOH溶液足量,写出燃料电池负极的电极反应式:________________________。
【答案】 2CH4(g)+O2(g)=2CH3OH(g) ΔH=(a+2b)kJ·mol-1 K=![]() 0.15mol·L-1·min-1 BD < KA=KB>KC CH3OH-6e-+8OH-=CO32-+6H2O
0.15mol·L-1·min-1 BD < KA=KB>KC CH3OH-6e-+8OH-=CO32-+6H2O
【解析】(1)本题考查热化学反应方程式的计算,甲烷和氧气反应制取甲醇的反应方程式为2CH4+O2→2CH3OH,①2CH4(g)+O2(g) =2CO(g)+4H2(g) ,②CO(g) +2H2(g)=CH3OH(g),①+2×②得出2CH4(g)+O2(g)=2CH3OH(g) △H=(a+2b)kJ·mol-1;(2)本题考查化学平衡常数以及反应速率的计算,根据化学平衡常数的定义,此反应的化学平衡常数的表达式为K=![]() ;根据化学反应速率定义,v(CH3OH)=0.75/10mol/(L·min)=0.075 mol/(L·min),根据化学反应速率之比等于化学计量数之比,即v(H2)=2v(CH3OH)=2×0.075mol/(L·min)=0.15mol/(L·min);(3)本题考查化学平衡状态的判断以及影响化学平衡的因素、影响化学平衡常数的因素,①A、用不同物质的化学反应速率判断达到化学平衡,要求反应方向是一正一逆,且化学反应速率之比等于化学计量数之比,消耗氢气和生成甲醇反应都是向正反应方向移动,因此不能判断是否达到平衡,故错误;B、根据化学平衡常数的定义,当组分的浓度不再改变,说明反应达到平衡,故正确;C、因为投入的物质的量之比与化学计量数之比相等,任何时刻,两者的转化率相等,因此不能判断是否达到化学平衡,故错误;D、根据M=m/n,组分都是气体,气体总质量不变,反应前后气体系数之和不相等,因此平均摩尔质量不变,说明反应达到平衡,故正确;②根据影响化学平衡移动的因素,增大压强,平衡向正反应方向移动,即压强越大,CO的转化率越大,P(A)<P(B);③化学平衡常数只受温度的影响,温度不变,化学平衡常数不变,即KA=KB,随着温度的升高,CO的转化率降低,说明平衡向逆反应方向移动,即正反应方向是放热反应,因此有KC<KA,综上所述KA=KB>KC;(4)通甲醇的一极为负极,通氧气的一极为正极,电解质为KOH,因此负极反应式为CH3OH+8OH--6e-=CO32-+6H2O。
;根据化学反应速率定义,v(CH3OH)=0.75/10mol/(L·min)=0.075 mol/(L·min),根据化学反应速率之比等于化学计量数之比,即v(H2)=2v(CH3OH)=2×0.075mol/(L·min)=0.15mol/(L·min);(3)本题考查化学平衡状态的判断以及影响化学平衡的因素、影响化学平衡常数的因素,①A、用不同物质的化学反应速率判断达到化学平衡,要求反应方向是一正一逆,且化学反应速率之比等于化学计量数之比,消耗氢气和生成甲醇反应都是向正反应方向移动,因此不能判断是否达到平衡,故错误;B、根据化学平衡常数的定义,当组分的浓度不再改变,说明反应达到平衡,故正确;C、因为投入的物质的量之比与化学计量数之比相等,任何时刻,两者的转化率相等,因此不能判断是否达到化学平衡,故错误;D、根据M=m/n,组分都是气体,气体总质量不变,反应前后气体系数之和不相等,因此平均摩尔质量不变,说明反应达到平衡,故正确;②根据影响化学平衡移动的因素,增大压强,平衡向正反应方向移动,即压强越大,CO的转化率越大,P(A)<P(B);③化学平衡常数只受温度的影响,温度不变,化学平衡常数不变,即KA=KB,随着温度的升高,CO的转化率降低,说明平衡向逆反应方向移动,即正反应方向是放热反应,因此有KC<KA,综上所述KA=KB>KC;(4)通甲醇的一极为负极,通氧气的一极为正极,电解质为KOH,因此负极反应式为CH3OH+8OH--6e-=CO32-+6H2O。

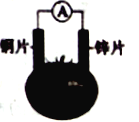
【题目】有甲、乙两位同学,他们一起做了如图所示的水果电池实验,测得数据如下表:
实验次数 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
1 | 锌 | 铜 | 菠萝 | 3 | 900 |
2 | 锌 | 铜 | 苹果 | 3 | 650 |
3 | 锌 | 铜 | 柑橘 | 3 | 850 |
4 | 锌 | 铜 | 西红柿 | 3 | 750 |
5 | 锌 | 铝 | 菠萝 | 3 | 650 |
6 | 锌 | 铝 | 苹果 | 3 | 450 |
甲同学提出的问题,乙同学解释不正确的是
①甲:实验6中的负极反应如何写? 乙:铝为负极:Al-3e-===Al3+
②甲:实验1、5电流方向为什么相反? 乙:实验1中锌为负极,电流由铜经导线流向锌;实验5中铝为负极,铝失去电子,电流由锌经导线流向铝
③甲:水果电池的电压与哪些因素有关? 乙:只跟水果的品种有关。
A. ③ B. ① C. ①②③ D. ②③