题目内容
【题目】常温下,0.1 mol·L-1的某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中水电离出的c(H+)=1×10-11molL-1
C.该溶液中水的离子积常数为1×1022
D.用 pH=11的NaOH 溶液 V1 L 与V2 L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则V1<V2
【答案】B
【解析】
试题分析:A、常温下,结合水的离子积常数计算,溶液中的氢离子浓度为0.001mol/L,溶液的pH=3,错误,不选A;B、酸溶液中水电离出的氢离子浓度等于溶液中的氢氧根离子浓度,所以该溶液中由水电离出的氢离子浓度为c(H+)=1×10-11mol/L,正确,选B;C、温度不变,水的离子积常数不变,所以该溶液中水的离子积常数为1×10-14,错误,不选C;D、pH=11的氢氧化钠溶液中氢氧化钠的浓度为0.001mol/L,氢氧化钠是强碱,HA为弱酸,假设HA为强酸,则氢氧化钠和算的体积之比为100:1,实际上HA为弱酸,要使混合溶液呈中性则氢氧化钠与HA体积之比小于100:1,但仍然存在V1>V2,错误,不选D;故答案为B。

【题目】钴及其化合物可应用与催化剂、电池、颜料与染料等。
(1)CoO是一种油漆添加剂,可通过反应①②制备。
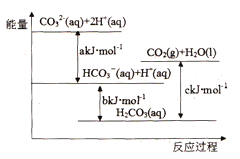
①2Co(s)+O2(g)=2CoO(s) ΔH1=akJ·mol-1
②2CoCO3(s) =CoO(s) + CO2 (g) ΔH2=akJ·mol-1
则反应2Co(s)+O2(g)+2CO2(g)=2CoO3(s) 的ΔH=_________。
(2)某锂电池的电解质可传导Li+,电池反应式为:LiC6+CoO2![]() C6+LiCoO2
C6+LiCoO2
①电池放电时,负极的电极反应式为_________,Li+向______移动(填“正极”或“负极“)。
②一种回收电极中Co元素的方法是:将LiCoO2与H2O2、H2SO4反应生成CoSO4。该反应的化学方程式为___________________。
(3)BASF高压法制备醋酸采用钴碘催化循环过程如图-1所示,该循环的总反应方程式为_________________(反应条件无需列出)

(4)某含钴催化剂可同时催化去除柴油车尾气中的碳烟(C)和NOx。不同温度下,将10mol模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图-2所示.
模拟尾气 | 气体 | 碳烟 | ||
NO | O2 | He | ||
物质的量分数或物质的量 | 0.25% | 5% | 94.75% | a mol |

①380℃时,测得排出的气体中含0.45 mol O2和0.0525 mol CO2,则Y的化学式为__________________。
②实验过程中采用NO模拟NOx,,而不采用NO2的原因是______________________。