题目内容
18.下列分离提纯物质的操作中,错误的是( )| A. | 用过滤的方法除去食盐中的泥沙 | |
| B. | 用渗析的方法除去淀粉中的氯离子 | |
| C. | 用结晶的方法分离氯化钠和硝酸钾 | |
| D. | 用分液的方法除去四氯化碳中混有的溴 |
分析 A.泥沙不溶于水,食盐溶于水;
B.离子可透过半透膜,而胶体不能;
C.氯化钠和硝酸钾的溶解度受温度影响不同;
D.四氯化碳中混有的溴,不分层.
解答 解:A.泥沙不溶于水,食盐溶于水,则过滤法可分离,故A正确;
B.离子可透过半透膜,而胶体不能,则渗析法可除去淀粉中的氯离子,故B正确;
C.氯化钠和硝酸钾的溶解度受温度影响不同,则利用结晶的方法分离氯化钠和硝酸钾,故C正确;
D.四氯化碳中混有的溴,不分层,不能利用分液法分离,应选蒸馏法,故D错误;
故选D.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
8.肼(N2H4)是一种重要的工业产品.资料表明,氨和次氯酸钠溶液反应能生成肼.相关物质的物理性质如下:
某学生对NH3与NaClO的反应进行实验探究:
(1)NaClO溶液呈碱性的原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.
(2)肼是一种二元弱碱.
①向肼的溶液中滴加石蕊试剂,溶液变蓝,其原因是(用化学用语表示)N2H4+H2O?N2H5++OH-.
②向水中持续通入NH3,未观察到白雾.推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝.该实验不能判断白雾中含有N2H4,理由是白雾中混有NH3,NH3也可以使湿润的红色石蕊试纸变蓝.
(3)进一步实验确认了A中生成了N2H4.步骤II中反应的化学方程式是(N2不参与反应)2NH3+NaClO═N2H4+NaCl+H2O.
(4)继续进行如下实验:
a.向A中加入过量稀硫酸,得到沉淀.过滤、洗涤,得到N2H6SO4固体.
b.将N2H6SO4固体溶于KOH溶液,蒸馏,得到高纯度、高浓度的N2H4溶液.
①通过检验Cl-来判断沉淀是否洗涤干净.检验Cl-操作是取少量洗涤后的滤液放入试管中,加入足量Ba(NO3)2溶液振荡,静置后,在上层清液中继续加入硝酸酸化的AgNO3溶液,若无白色沉淀产生,则沉淀洗涤干净.
②提纯含有NaCl的N2H6SO4固体的实验方法可以是重结晶.
③实验b中省略的实验操作是蒸馏.
(5)常见无机酸与N2H4反应的能力顺序如下:H3PO4<H2SO4<HClO4.原因是P、S、Cl都是第三周期元素.同一周期的元素,从左到右,核电荷数逐渐增大,原子半径减小,得电子能力逐渐增强,元素的非金属性逐渐增强,非金属最高价含氧酸与N2H4的反应能力逐渐增强.
| 性状 | 熔点/℃ | 沸点/℃ | 水溶性 | |
| N2H4 | 无色液体 | 1.4 | 113 | 与水混溶 |
| N2H6SO4 | 无色晶体 | 254 | / | 微溶于冷水,易溶于热水 |
| 步骤 | 操作 | 现象 |
| I | 取10g NaClO固体,加入100mL水 | 固体溶解,溶液呈碱性 |
| II |  | 液面上方出现白雾 |
(2)肼是一种二元弱碱.
①向肼的溶液中滴加石蕊试剂,溶液变蓝,其原因是(用化学用语表示)N2H4+H2O?N2H5++OH-.
②向水中持续通入NH3,未观察到白雾.推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝.该实验不能判断白雾中含有N2H4,理由是白雾中混有NH3,NH3也可以使湿润的红色石蕊试纸变蓝.
(3)进一步实验确认了A中生成了N2H4.步骤II中反应的化学方程式是(N2不参与反应)2NH3+NaClO═N2H4+NaCl+H2O.
(4)继续进行如下实验:
a.向A中加入过量稀硫酸,得到沉淀.过滤、洗涤,得到N2H6SO4固体.
b.将N2H6SO4固体溶于KOH溶液,蒸馏,得到高纯度、高浓度的N2H4溶液.
①通过检验Cl-来判断沉淀是否洗涤干净.检验Cl-操作是取少量洗涤后的滤液放入试管中,加入足量Ba(NO3)2溶液振荡,静置后,在上层清液中继续加入硝酸酸化的AgNO3溶液,若无白色沉淀产生,则沉淀洗涤干净.
②提纯含有NaCl的N2H6SO4固体的实验方法可以是重结晶.
③实验b中省略的实验操作是蒸馏.
(5)常见无机酸与N2H4反应的能力顺序如下:H3PO4<H2SO4<HClO4.原因是P、S、Cl都是第三周期元素.同一周期的元素,从左到右,核电荷数逐渐增大,原子半径减小,得电子能力逐渐增强,元素的非金属性逐渐增强,非金属最高价含氧酸与N2H4的反应能力逐渐增强.
9.对于溶液中某些离子的检验及结论正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有碳酸根离子 | |
| B. | 加入氯化钡溶液有白色沉淀生成,再加盐酸,沉淀不消失,一定有硫酸根离子 | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有氨根离子 | |
| D. | 为检验酸性溶液中的氯离子和硫酸根离子,应先加硝酸银溶液,滤去沉淀后加硝酸钡溶液 |
3.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 1molCl2参加化学反应获得的电子数都是2NA | |
| B. | 6.4 gO2与O3的混合物中所含O原子数一定为0.4NA | |
| C. | 含4nmol HCl的浓盐酸与足量的MnO2加热反应,生成的Cl2分子数为nNA | |
| D. | 1mol某气体的体积为22.4L,该气体的状况一定是标准状况 |
10.下列说法正确的是( )
| A. | ${\;}_{8}^{16}$O、${\;}_{8}^{18}$O为不同的核素,有不同的化学性质 | |
| B. | H2、SO2、NH3三种气体都可用浓硫酸干燥 | |
| C. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| D. | 陶瓷、玻璃、水泥、大理石的主要成分都是硅酸盐 |
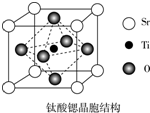 氢能被视作连接化石能源和可再生能源的重要桥梁.
氢能被视作连接化石能源和可再生能源的重要桥梁.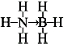 ;与氨硼烷互为等电子体的有机化合物是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机化合物是CH3CH3(写结构简式).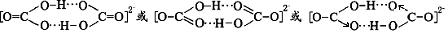 .
.