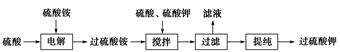
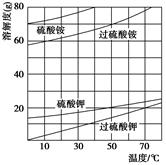
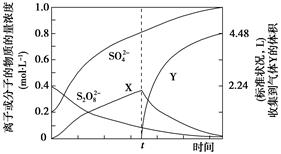
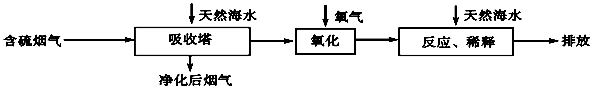
题目内容
有一混合气体,可能由H2、O2、NH3、N2、CO2、HCl和He中的两种或多种组成。常温下,取此气体200 mL进行实验,实验的过程和结果如下:
①观察此混合气体为无色。
②将此气体通过浓硫酸,气体体积减少了40 mL。
③将②中剩余的气体,通过Na2O2固体,气体体积变为120 mL。
④将③中剩余的气体引燃充分反应后,冷却至常温,气体体积又减少了105 mL。(上述气体的体积都是相同条件下测定的)。
⑤剩余气体通过加热的铜网,剩余10 mL气体。
根据上述实验,试推断:
(1)混合气体中肯定存在的气体是_________,它们的体积分别为_________。
(2)混合气体中肯定不存在的气体是__________________。
(3)混合气体中可能含有的气体是_________,其体积共为_________。
(1)H2、NH3、CO2 H2 70 mL、NH3 40 mL、CO2 80 mL
(2)O2、HCl (3)N2和He 10 mL
解析

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。
② Cr2O72-+ H2O 2CrO42-+ 2H+
2CrO42-+ 2H+
(1)K2Cr2O7中Cr元素的化合价是 。
(2)滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式) ;
生成滤渣1中红褐色物质反应的化学方程式是。
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是。
(4)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(5)莫尔法是一种沉淀滴定法,以Na2CrO4 为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
①滴定终点的现象是。
②若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是(选填编号)
A.NaCl B.K2CrO4 C.BaBr2
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下: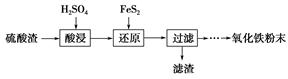
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率;②________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42—,该反应的离子方程式为________________________________________________________________________。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入稀盐酸、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应的化学方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62—
Sn2++4Cl-+2HgCl2=SnCl62—+Hg2Cl2↓
6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量________(填“偏高”、“偏低”或“不变”,下同);
②若不加HgCl2,则测定的Fe3+量________。
(4)①可选用________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是________________________________________________________________________(用离子方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀硝酸、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。
请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:________________________________________________________;
b.沉淀:__________________________________________________________;
c.分离,洗涤;
d.烘干,研磨。
工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下: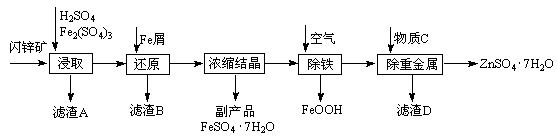
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 ,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为 、 、过滤、干燥。


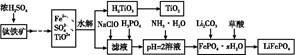
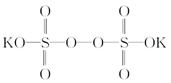 )具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下: