题目内容
已知: CH3CH2CH2CH3(g)+6.5O2(g) == 4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
(CH3)2CHCH3(g)+6.5O2(g) == 4CO2(g)+5H2O(l) ΔH=-2 869kJ·mol-1
下列说法正确的是( )
A. 正丁烷分子储存的能量大于异丁烷分子
B. 正丁烷的稳定性大于异丁烷
C. 异丁烷转化为正丁烷的过程是一个放热过程
D. 异丁烷分子中的碳氢键比正丁烷的多
【答案】
A
【解析】根据盖斯定律可知,①-②即得到 CH3CH2CH2CH3(g)=(CH3)2CHCH3(g),所以该反应的反应热△H=-2 878 kJ·mol-1+2 869kJ·mol-1=-9kJ/mol,即该反应是放热反应,所以反应物的总能量高于生成物的总能量,则异丁烷比正丁烷稳定性强,所以选项A正确,BC是不正确。根据结构简式可知,两种分子中碳氢键的数目是相同的,选项D不正确,答案选D。

练习册系列答案
相关题目


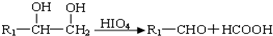

 ,W的溶液能使pH试纸变红,还能发生银镜反应.
,W的溶液能使pH试纸变红,还能发生银镜反应.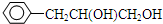

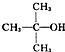 结构相似的醇不能被氧化成醛或酸.“智能型”大分子,在生物工程中有广泛的应用前景.PMAA就是一种“智能型”大分子,可用于生物制药中大分子与小分子的分离.下列是以物质A为起始反应物合成高分子化合物PMAA的路线:
结构相似的醇不能被氧化成醛或酸.“智能型”大分子,在生物工程中有广泛的应用前景.PMAA就是一种“智能型”大分子,可用于生物制药中大分子与小分子的分离.下列是以物质A为起始反应物合成高分子化合物PMAA的路线:

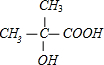
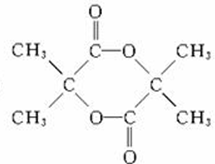
 +H2O
+H2O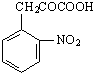 +C2H5OH
+C2H5OH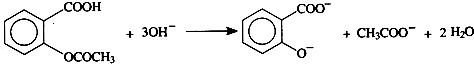
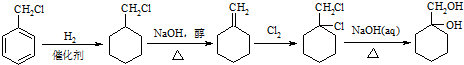
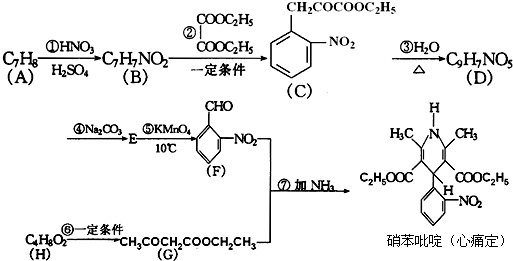
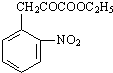
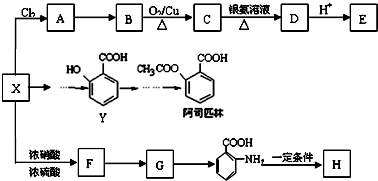 某芳香烃X是一种重要的有机化工原料,它的相对分子质量为92.研究部门以X为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去),其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO.
某芳香烃X是一种重要的有机化工原料,它的相对分子质量为92.研究部门以X为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去),其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO.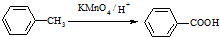
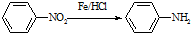 (苯胺,易被氧化)
(苯胺,易被氧化)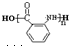
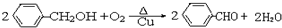

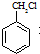 和其他无机物合成
和其他无机物合成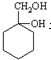 设计最合理的方案,写出合成路线(需注明反应条件)
设计最合理的方案,写出合成路线(需注明反应条件)