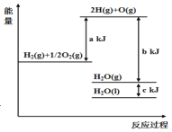
题目内容
【题目】利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2,装置如图所示。下列说法不正确的是( )
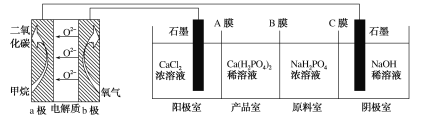
A.a极反应:CH4-8e-+4O2-=CO2+2H2O
B.A膜和C膜均为阴离子交换膜
C.可用铁电极替换阴极的石墨电极
D.a极上通入标况下2.24L甲烷,阳极室Ca2+减少0.4mol
【答案】B
【解析】
根据题干信息,左侧为原电池,右侧为电解池,a极为原电池的负极,电极反应式CH4 -8e-+4O2-=CO2+2H2O,b极为正极,电极反应式O2+4e-=2O2-,阳极室的电极反应:2Cl--2e-=Cl2↑,阳极室的Ca2+通过A膜(阳离子交换膜)进入产品室,阴极室的电极反应:2H2O+2e-=H2↑+2OH-,阴极不参与反应,可以用铁电极替换石墨电极,原料室的Na+通过C膜(阳离子交换膜)进入阴极室,原料室的H2PO4-通过B膜(阴离子交换膜)进入产品室,在产品室中制得产品Ca(H2PO4)2,据此分析解答。
A.由上述分析知,a极为负极,负极上甲烷发生氧化反应,电极反应式为:CH4-8e-+4O2-=CO2+2H2O,A选项正确;
B.根据上述分析可知,A膜、C膜均为阳离子交换膜,B选项错误;
C.阴极电极不参与反应,可用铁替换阴极的石墨电极,C选项正确;
D.a极上通入2.24 L(标准状况下)甲烷,转移电子0.8mol,根据e-守恒,阳极室中Cl-失去的电子也为0.8mol,所以消耗的Cl-0.8mol,即负电荷减少0.8mol,所以阳极室中带正电荷的0.4molCa2+移向产品室,即Ca2+减少0.4mol,D选项正确;
答案选B。

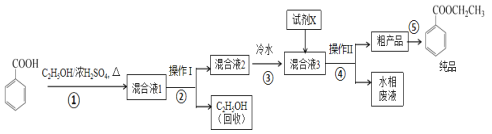
【题目】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如图:
试剂相关性质如下表:
苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
常温性状 | 白色针状晶体 | 无色液体 | 无色透明液体 |
沸点/℃ | 249.0 | 78.0 | 212.6 |
相对分子量 | 122 | 46 | 150 |
溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
(1)为提高原料苯甲酸的纯度,可采用的纯化方法为__。
(2)步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入12.2g纯化后的苯甲酸晶体,30mL无水乙醇(约0.5mol)和3mL浓硫酸,加入沸石,加热至微沸,回流反应1.5~2h。仪器A的作用是__。

(3)随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为__。
(4)反应结束后,对C中混合液进行分离提纯,操作I是_;操作II所用的玻璃仪器除了烧杯外还有__。
(5)反应结束后,步骤③中将反应液倒入冷水的目的除了溶解乙醇外,还有__;加入试剂X为___(填写化学式)。
(6)最终得到产物纯品10.0g,实验产率为__%(保留三位有效数字)。