题目内容
【题目】为比较Fe3+、Cu2+和MnO2对H2O2分解反应的催化效果,某化学研究小组的同学分别设计了如图甲、乙、丙所示的实验。请回答相关问题:

(1)同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果。其结论________(填“合理”或“不合理”)。理由是_______________________。
(2)同学Y利用乙装置,测定相同时间内产生气体的体积,从而探究Fe3+和Cu2+对H2O2分解的催化效果。试回答下列问题:
① 仪器A的名称是________。
② 除了必要的试剂和图乙所示的仪器外,还有一样不能缺少的实验用品是___________。
③ 实验时组装好装置乙,关闭A的活塞,将注射器活塞向外拉出一段。这一操作的实验目的是_______________________。
④ 测定气体体积时,是否需要事先排除乙装置内的空气______(填“需要”或“不需要”)。
(3)同学Z利用丙装置探究MnO2对H2O2分解的催化效果。将50 mL 双氧水一次性加入盛有0.10 mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)]和时间(t/min)的关系如图所示。

①图中 b________(填“大于”、“小于”或“等于”)90 mL。
② 同学Z除了探究MnO2对H2O2分解速率的影响情况,还可得出_______________对H2O2分解速率的影响情况
【答案】不合理 阴离子种类不同 分液漏斗 秒表(其它合理答案也可) 检查装置的气密性 不需要 小于 浓度
【解析】
(1)同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,不合理。催化剂能改变化学反应的速率,这里是加快速率,要证明比对分解催化效果好,要使选择的试剂中阴离子种类相同,所以Fe3+和Cu2+对H2O2分解的催化效果,其结论不合理;
(2)① 仪器A的名称是分液漏斗。
② 反应速率是根据测定相同时间内产生气体的体积来衡量的,除了必要的试剂和图乙所示的仪器外,还有一样不能缺少的实验用品是秒表;
③ 实验时组装好装置乙,为保证测定相同时间内产生气体的体积的准确性,要检查装置的气密性,操作是:组装好装置乙,关闭A的活塞,将注射器活塞向外拉出一段,松手后,看是否回到原位,回到原位证明气密性良好;
④ 装置乙的空气不影响测定气体的体积,测定气体体积时,不需要事先排除乙装置内的空气;
(3)①图中b:图象斜率的大小反映反应速率快慢,斜率越大,反应速率越快,将50mL过氧化氢一次性加入烧瓶中,由于反应物浓度减小,反应速率减慢,3min~4min生成10mL气体,那么2min~3min生成的气体应大于10mL,故b小于90mL;
② 根据图丁的斜率可知:在加入催化剂的条件下,随着反应物浓度的降低,反应速率减慢,还可得出浓度对H2O2分解速率的影响情况。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】下列方案设计能达到实验目的的是
A | B | C | D |
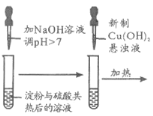
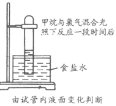
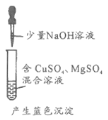
检验淀粉是否水解 | 由褪色快慢研究反应物浓度对反应速率的影响 | 证明发生了取代反应 | 验证Ksp[Cu(OH)2]<Ksp[Mg(OH)2 ] |
|
|
|
|
A.AB.BC.CD.D