题目内容
下列关于反应K2Cr2O7+HCl→KCl+CrCl3+C12+H2O(未配平)的说法正确的是
- A.反应中K2Cr2O7为还原剂,HCl为氧化剂
- B.方程式配平后,HCl的化学计量数为14
- C.当0.1molK2Cr2O7参加反应时,反应中转移电子0.3mol
- D.当有0.1molCl2生成时,被还原的HCl为0.2mol
B
分析:A、氧化还原反应中得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂.
B、氧化还原反应方程式的配平依据是得失电子数相等.
C、根据K2Cr2O7与转移电子的关系式计算.
D、根据氯气和参加氧化还原反应的HCl的关系式计算.
解答:A、K2Cr2O7+HCl→KCl+CrCl3+C12+H2O,该反应中,HCl→C12氯元素失电子化合价升高,所以HCl作还原剂;
K2Cr2O7→CrCl3铬元素得电子化合价降低,所以K2Cr2O7作氧化剂,故A错误.
B、K2Cr2O7+HCl→KCl+CrCl3+C12+H2O,该反应中,一个HCl分子参加氧化还原反应失去1个电子,一个K2Cr2O7参加氧化还原反应得到6个电子,其最小公倍数是6,然后根据各元素的原子守恒进行配平,所以该反应方程式为
1K2Cr2O7+14HCl=2KCl+2CrCl3+3C12+7H2O,故B正确.
C、1K2Cr2O7+14HCl=2KCl+2CrCl3+3C12+7H2O转移电子
1mol 6mol
0.1mol 0.6mol
所以当0.1molK2Cr2O7参加反应时,反应中转移电子0.6mol,故C错误.
D、1K2Cr2O7+8HCl+6HCl(被氧化)=2KCl+2CrCl3+3C12+7H2O
6mol 3mol
0.2mol 0.1mol
当有0.1molCl2生成时,被氧化的HCl为0.2mol,故D错误.
故选B.
点评:本题以氧化还原反应的配平为载体考查了氧化剂和还原剂的判断、反应物和转移电子的关系等知识点,易错选项是D,注意该反应中部分HCl作还原剂,部分只起酸的作用.
分析:A、氧化还原反应中得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂.
B、氧化还原反应方程式的配平依据是得失电子数相等.
C、根据K2Cr2O7与转移电子的关系式计算.
D、根据氯气和参加氧化还原反应的HCl的关系式计算.
解答:A、K2Cr2O7+HCl→KCl+CrCl3+C12+H2O,该反应中,HCl→C12氯元素失电子化合价升高,所以HCl作还原剂;
K2Cr2O7→CrCl3铬元素得电子化合价降低,所以K2Cr2O7作氧化剂,故A错误.
B、K2Cr2O7+HCl→KCl+CrCl3+C12+H2O,该反应中,一个HCl分子参加氧化还原反应失去1个电子,一个K2Cr2O7参加氧化还原反应得到6个电子,其最小公倍数是6,然后根据各元素的原子守恒进行配平,所以该反应方程式为
1K2Cr2O7+14HCl=2KCl+2CrCl3+3C12+7H2O,故B正确.
C、1K2Cr2O7+14HCl=2KCl+2CrCl3+3C12+7H2O转移电子
1mol 6mol
0.1mol 0.6mol
所以当0.1molK2Cr2O7参加反应时,反应中转移电子0.6mol,故C错误.
D、1K2Cr2O7+8HCl+6HCl(被氧化)=2KCl+2CrCl3+3C12+7H2O
6mol 3mol
0.2mol 0.1mol
当有0.1molCl2生成时,被氧化的HCl为0.2mol,故D错误.
故选B.
点评:本题以氧化还原反应的配平为载体考查了氧化剂和还原剂的判断、反应物和转移电子的关系等知识点,易错选项是D,注意该反应中部分HCl作还原剂,部分只起酸的作用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
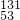 I与
I与 Cs的中子数相等
Cs的中子数相等