题目内容
在反应:3BrF3+5H2O═HBrO3+Br2+O2+9HF中(已知BrF3中Br为+3价,F为-1价),当有2mol水参加氧化还原反应时,由水还原的BrF3和总的被还原的BrF3物质的量分别是
- A.1mol、3mol
- B.2mol、3mol
- C.4/3mol、2mol
- D.3mol、1mol
C
分析:在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用,根据反应中氧元素前后化合价变化可知,起还原剂作用的水占参加反应的水的 .2mol水参加氧化还原反应,根据氧化还原反应中电子转移守恒计算被水还原的BrF3的物质的量.2mol水参加氧化还原反应,根据氧元素守恒可知,生成氧气1mol,被还原的BrF3生成Br2,根据方程式计算生成溴1mol,利用溴元素守恒被还原的BrF3物质的量.
.2mol水参加氧化还原反应,根据氧化还原反应中电子转移守恒计算被水还原的BrF3的物质的量.2mol水参加氧化还原反应,根据氧元素守恒可知,生成氧气1mol,被还原的BrF3生成Br2,根据方程式计算生成溴1mol,利用溴元素守恒被还原的BrF3物质的量.
解答:在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用,根据反应中氧元素前后化合价变化可知,起还原剂作用的水占参加反应的水的 ,所以2mol水参加氧化还原反应,令被水还原的BrF3的物质的量为xmol,根据电子转移守恒,则:
,所以2mol水参加氧化还原反应,令被水还原的BrF3的物质的量为xmol,根据电子转移守恒,则:
2mol×2=xmol×(3-0)
解得:x=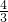 ,
,
2mol水参加氧化还原反应,根据氧元素守恒可知,生成氧气1mol,被还原的BrF3生成Br2,由反应3BrF3+5H2O=HBrO3+Br2+9HF+O2可知,生成Br21mol,所以根据溴元素守恒,可知被还原的BrF3物质的量为1mol×2=2mol.
故选C.
点评:本题考查氧化还原反应的计算、氧化还原反应基本概念,难度中等,关键根据化合价判断氧化剂、还原剂,利用电子转移守恒、元素守恒计算.
分析:在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用,根据反应中氧元素前后化合价变化可知,起还原剂作用的水占参加反应的水的
 .2mol水参加氧化还原反应,根据氧化还原反应中电子转移守恒计算被水还原的BrF3的物质的量.2mol水参加氧化还原反应,根据氧元素守恒可知,生成氧气1mol,被还原的BrF3生成Br2,根据方程式计算生成溴1mol,利用溴元素守恒被还原的BrF3物质的量.
.2mol水参加氧化还原反应,根据氧化还原反应中电子转移守恒计算被水还原的BrF3的物质的量.2mol水参加氧化还原反应,根据氧元素守恒可知,生成氧气1mol,被还原的BrF3生成Br2,根据方程式计算生成溴1mol,利用溴元素守恒被还原的BrF3物质的量.解答:在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用,根据反应中氧元素前后化合价变化可知,起还原剂作用的水占参加反应的水的
 ,所以2mol水参加氧化还原反应,令被水还原的BrF3的物质的量为xmol,根据电子转移守恒,则:
,所以2mol水参加氧化还原反应,令被水还原的BrF3的物质的量为xmol,根据电子转移守恒,则:2mol×2=xmol×(3-0)
解得:x=
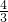 ,
,2mol水参加氧化还原反应,根据氧元素守恒可知,生成氧气1mol,被还原的BrF3生成Br2,由反应3BrF3+5H2O=HBrO3+Br2+9HF+O2可知,生成Br21mol,所以根据溴元素守恒,可知被还原的BrF3物质的量为1mol×2=2mol.
故选C.
点评:本题考查氧化还原反应的计算、氧化还原反应基本概念,难度中等,关键根据化合价判断氧化剂、还原剂,利用电子转移守恒、元素守恒计算.

练习册系列答案
相关题目