题目内容
在100 mL某浓度的NaOH溶液中通入一定量的CO2气体,得到溶液X,再向溶液X中逐滴加入0.1mol/L的盐酸,产生的气体体积与加入盐酸的体积关系如下图所示,有关说法错误的是
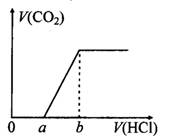
- A.若a:b<1:2,则0~a段发生的离子反应为:CO32-+H+= HCO3-
- B.若a:b>l:2,且b="20" mL,则原NaOH溶液的浓度为0.02 mol/L
- C.若a:b=1:2,则溶液X中离子浓度满足:c(H+)+c(HCO3-)=c(OH-)-c(H2CO3)
- D.a:b为任意值时,溶液X中离子浓度均满足:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
C
试题分析:A、若a:b<1:2,则溶液X的溶质为Na2CO3和NaHCO3,刚开始滴加盐酸时反应为Na2CO3+HCl=NaHCO3+NaCl,正确;B、b点溶液的溶质为NaCl,由Na元素、Cl元素守恒可知:n(NaOH)="n(NaCl)=n(HCl)=0.002" mol,故原溶液中NaOH浓度为0.02 mol/L,正确;C、若a:b=l:2,则溶液X的溶质为Na2CO3,质子守恒式有:c(H+)+c(HCO3-)=c(OH-)一2c(H2CO3),错误;D、a:b为任意值时溶液X均满足电荷守恒,即c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),正确。
考点:考查电解质溶液,涉及离子反应及量的关系,离子方程式书写等。
试题分析:A、若a:b<1:2,则溶液X的溶质为Na2CO3和NaHCO3,刚开始滴加盐酸时反应为Na2CO3+HCl=NaHCO3+NaCl,正确;B、b点溶液的溶质为NaCl,由Na元素、Cl元素守恒可知:n(NaOH)="n(NaCl)=n(HCl)=0.002" mol,故原溶液中NaOH浓度为0.02 mol/L,正确;C、若a:b=l:2,则溶液X的溶质为Na2CO3,质子守恒式有:c(H+)+c(HCO3-)=c(OH-)一2c(H2CO3),错误;D、a:b为任意值时溶液X均满足电荷守恒,即c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),正确。
考点:考查电解质溶液,涉及离子反应及量的关系,离子方程式书写等。

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目