题目内容
下列化学方程式中,表示电子转移的方向和数目都正确的是( )A.
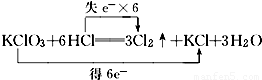
B.
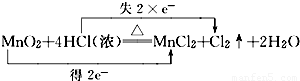
C.
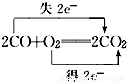
D.
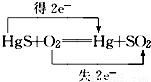
【答案】分析:化合价升高的元素的原子失去电子,化合价降低的元素的原子得到电子,得失电子数目相等,失去多少电子化合价就升高几价,得到多少电子化合价就降低几价.
解答:解:A、根据化合价不能交叉的原则,氯酸钾中氯元素的化合价应从+5价降到0价,盐酸中氯元素的化合价应从-1价升高到0价,转移电子数是5mol,即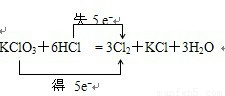 ,故A错误;
,故A错误;
B、锰元素化合价降低2价,氯元素化合价升高2价,反应转移电子2mol,故B正确;
C、所有碳元素共失去4mol的电子,所有氧元素共得到4mol的电子,故转移电子是应为4mol,不是2mol,故C错误;
D、汞和硫元素化合价均升高均失去电子,氧元素化合价降低得到电子,故D错误.
故选B.
点评:本题考查氧化还原反应的实质有关知识,可以根据所学知识进行回答,难度不大.
解答:解:A、根据化合价不能交叉的原则,氯酸钾中氯元素的化合价应从+5价降到0价,盐酸中氯元素的化合价应从-1价升高到0价,转移电子数是5mol,即
 ,故A错误;
,故A错误;B、锰元素化合价降低2价,氯元素化合价升高2价,反应转移电子2mol,故B正确;
C、所有碳元素共失去4mol的电子,所有氧元素共得到4mol的电子,故转移电子是应为4mol,不是2mol,故C错误;
D、汞和硫元素化合价均升高均失去电子,氧元素化合价降低得到电子,故D错误.
故选B.
点评:本题考查氧化还原反应的实质有关知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
在一定条件下,CO(g)和H2(g)发生反应:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,在容积固定的2L密闭容器中充入2mol CO(g)和4mol H2(g)发生反应,测定在不同温度、不同时段下CO的转化率如下表:下列说法中正确的是( )
| CO转化率 T(℃) |
1小时 | 2小时 | 3小时 | 4小时 |
| T1 | 40% | 70% | 80% | 80% |
| T2 | 55% | 65% | a1 | a2 |
| A、热化学方程式中a>0 |
| B、T1℃下,在第一小时内用H2表示的化学反应速率为0.4mol/(L?h) |
| C、T1℃下,该反应的化学平衡常数为25 |
| D、T2℃下,ɑ1=ɑ2>80% |
 归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).
归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).



