题目内容
 归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).
归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 217 | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)碲的化合价可能有
-2,+4,+6
-2,+4,+6
(2)氢硒酸有较强的
还原性
还原性
(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为2H2Se+O2=2H2O+2Se↓
2H2Se+O2=2H2O+2Se↓
.(3)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
1
1
Al2Te3+6H2O
6H2O
一2
2
Al(OH)3↓+3
3
H2Te↑(4)已知在常温下,H2和S反应生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式:
H2S(g)=H2(g)+S(s)△Η=+112.2kJ?mol-1
H2S(g)=H2(g)+S(s)△Η=+112.2kJ?mol-1
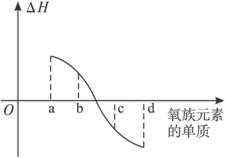
.(5)右图所示为上述表格中氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应的反应热.则:b代表
硒
硒
,d代表氧气
氧气
(均写单质名称).分析:(1)根据硒的化合价来推测;
(2)根据氢硒酸中硒的化合价处于-2价,处于最低价;
(3)根据质量守恒定律来解题;
(4)根据热化学方程式的书写方法;
(5)根据氧族元素的单质与氢气化合的越来越难,推导出a、b、c、d分别为Te、Se、S、O2.
(2)根据氢硒酸中硒的化合价处于-2价,处于最低价;
(3)根据质量守恒定律来解题;
(4)根据热化学方程式的书写方法;
(5)根据氧族元素的单质与氢气化合的越来越难,推导出a、b、c、d分别为Te、Se、S、O2.
解答:解:(1)因硒的化合价有-2,+4,+6,碲的性质与硒相似,所以碲的化合价可能有-2,+4,+6,
故答案为:-2,+4,+6;
(2)因氢硒酸中硒的化合价处于-2价,处于最低价,具有还原性,能被空气中的氧气氧化,
故答案为:还原性;2H2Se+O2=2H2O+2Se↓
(3)因A12Te3+6H2O=2A1(OH)3↓+3H2Te↑,
故答案为:1;6H2O;2;3;
(4)因H2和S反应生成17g H2S放出56.1KJ的热量,硫化氢分解的热化学方程式:H2S(g)=H2(g)+S(s)△H=+112.2 kJ?mol-1,
故答案为:H2S(g)=H2(g)+S(s)△H=+112.2 kJ?mol-1;
(5)因氧族元素的单质与氢气化合的越来越难,推导出a、b、c、d分别为Te、Se、S、O2,
故答案为:硒;氧气;
故答案为:-2,+4,+6;
(2)因氢硒酸中硒的化合价处于-2价,处于最低价,具有还原性,能被空气中的氧气氧化,
故答案为:还原性;2H2Se+O2=2H2O+2Se↓
(3)因A12Te3+6H2O=2A1(OH)3↓+3H2Te↑,
故答案为:1;6H2O;2;3;
(4)因H2和S反应生成17g H2S放出56.1KJ的热量,硫化氢分解的热化学方程式:H2S(g)=H2(g)+S(s)△H=+112.2 kJ?mol-1,
故答案为:H2S(g)=H2(g)+S(s)△H=+112.2 kJ?mol-1;
(5)因氧族元素的单质与氢气化合的越来越难,推导出a、b、c、d分别为Te、Se、S、O2,
故答案为:硒;氧气;
点评:本题主要考查了氧族元素的性质,考查了类推法的应用,应根据不同知识的特点类推,不能盲目类推,并注意知识点与方法的有机结合,做到具体问题能具体分析.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
(16分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃ | —218。4 | 113 | | 450 |
| 单质沸点(℃) | —183 | 444.6 | 685 | 1390 |
| 主要化合价 | —2 | —2,+4,+6 | —2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)晶体硫属于 晶体,硒的焙点T的范围可能是 。
(2)碲的化合价可能有 。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式)。
(4)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为 。
(5)工业上Al2Te3可用来制各H2Te,完成下列化学方程式:
Al2Te3+ ( )一 A1(OH)3↓+ H2Te↑