题目内容
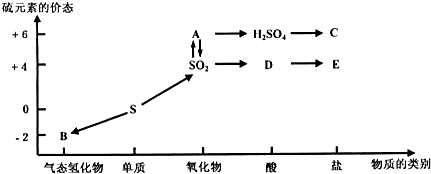
在一定条件下,CO(g)和H2(g)发生反应:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,在容积固定的2L密闭容器中充入2mol CO(g)和4mol H2(g)发生反应,测定在不同温度、不同时段下CO的转化率如下表:下列说法中正确的是( )
| CO转化率 T(℃) |
1小时 | 2小时 | 3小时 | 4小时 |
| T1 | 40% | 70% | 80% | 80% |
| T2 | 55% | 65% | a1 | a2 |
| A、热化学方程式中a>0 |
| B、T1℃下,在第一小时内用H2表示的化学反应速率为0.4mol/(L?h) |
| C、T1℃下,该反应的化学平衡常数为25 |
| D、T2℃下,ɑ1=ɑ2>80% |
分析:A、根据单位时间内物质的转化率的变化确定温度的高低;
B、化学反应速率之比等于方程式的系数之比;
C、根据三行式计算化学平衡常数数;
D、温度不同,化学反应速率不同,达到平衡的时间不一样.
B、化学反应速率之比等于方程式的系数之比;
C、根据三行式计算化学平衡常数数;
D、温度不同,化学反应速率不同,达到平衡的时间不一样.
解答:解:A、在时间间隔一个小时内,T1温度下一氧化碳的转化率变化较大,所以T1温度较高,在1小时时,温度从T1到T2,降低温度,则一氧化碳的转化率降低,所以平衡逆向移动,该反应是吸热的,即a>0,故A正确;
B、T1℃下,在第一小时内用H2表示的化学反应速率是一氧化氮速率的一半,即为0.2mol/(L?h),故B错误;
C、T1℃下,CO(g)+2H2(g)?CH3OH(g)
初始浓度:1 2 0
变化浓度:0.8 1.6 0.8
平衡浓度:0.2 0.4 0.8
则K=
=25,故C正确;
D、反应进行的温度不同,所以化学反应速率不同,因此达到平衡的时间不一样,所以ɑ1、ɑ2不相等,故D错误.
故选AC.
B、T1℃下,在第一小时内用H2表示的化学反应速率是一氧化氮速率的一半,即为0.2mol/(L?h),故B错误;
C、T1℃下,CO(g)+2H2(g)?CH3OH(g)
初始浓度:1 2 0
变化浓度:0.8 1.6 0.8
平衡浓度:0.2 0.4 0.8
则K=
| 0.8 |
| 0.2×0.42 |
D、反应进行的温度不同,所以化学反应速率不同,因此达到平衡的时间不一样,所以ɑ1、ɑ2不相等,故D错误.
故选AC.
点评:本题考查了化学平衡的影响因素分析,数据分析利用的能力,反应速率的计算应用,题目难度中等.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目

 通过消去反应制备Ⅰ的化学方程式为
通过消去反应制备Ⅰ的化学方程式为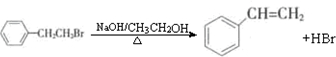

 (任写一种)
(任写一种) 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有