题目内容
在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:(1)2 min末SO3的浓度 ;(2)2 min内SO2的平均反应速率 (3)2 min末SO2与O2的压强的比 。
(第(1)题3分,其余每空2分)1.2 mol/L; 0.6 mol/(L·min);2:1
试题分析:该反应的化学方程式是
2SO2 + O2
 2SO3
2SO3起始浓度(mol/L) 2 1 0
转化浓度(mol/L) 1.2 0.6 1.2
2min末浓度(mol/L) 0.8 0.4 1.2
所以2 min末SO3的浓度是1.2mol/L
2 min内SO2的平均反应速率是
 =0.6 mol/(L·min)
=0.6 mol/(L·min)在温度和体积相同的条件下,气体的压强之比是物质的量之比
所以2 min末SO2与O2的压强的比1.2:0.6=2:1
点评:在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某时刻的量,然后依据已知条件列式计算即可,有利于培养学生的规范答题能力。

练习册系列答案
相关题目
 2HI(g)(HI为无色气体)已达平衡状态的是( )
2HI(g)(HI为无色气体)已达平衡状态的是( ) 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( ) Fe(s)+ CO2(g) △H>0
Fe(s)+ CO2(g) △H>0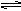 2NH3达到平衡的标志是
2NH3达到平衡的标志是  CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2 L的密闭容器中加入4 mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2 L的密闭容器中加入4 mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
 O2(g)=CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol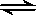 2C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法正确的是
2C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法正确的是