题目内容
某温度下,在容积不变的密闭容器中存在下列可逆反应:A(g)+3B(g) 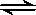 2C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法正确的是
2C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法正确的是
A.平衡不移动 B.平衡时C的物质的量增大
C.平衡向逆反应方向移动 D.平衡时混合气体的平均摩尔质量减少
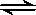 2C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法正确的是
2C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法正确的是 A.平衡不移动 B.平衡时C的物质的量增大
C.平衡向逆反应方向移动 D.平衡时混合气体的平均摩尔质量减少
B
试题分析:保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则相当于是缩小容器的容积增大压强。由于该反应是体积减小的可逆反应,所以平衡向正反应方向移动,因此选项B正确,平衡时混合气体的平均摩尔质量增大,D不正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确外界条件是如何影响平衡状态的,并能结合题意灵活运用即可。

练习册系列答案
相关题目
 C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是: ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B物质的量浓度
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是: ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B物质的量浓度 2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算
2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下: A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是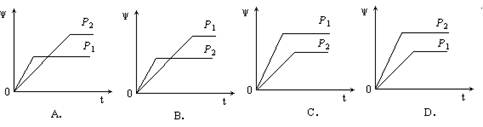
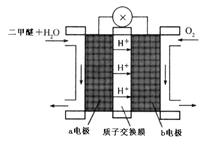
 丙+丁+水。
丙+丁+水。
 2SO3(g) △H<0。反应的平衡常数表达式K= ;反应达平衡时,若改变其中一个条件x,则符合图中曲线的是
2SO3(g) △H<0。反应的平衡常数表达式K= ;反应达平衡时,若改变其中一个条件x,则符合图中曲线的是