题目内容
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
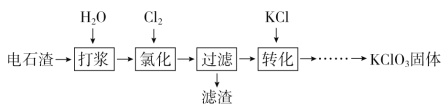
(1)氯化过程控制电石渣过量、在75 ℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2。
①电石与H2O反应的化学方程式为___________________。生成Ca(ClO)2的化学方程式为___________________。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有________(填序号)。
A.适当加快通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为:6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O,氯化完成后过滤。
75 ℃时 Ca(ClO)2进一步转化为Ca(ClO3)2的反应方程式为__________________。
滤渣的主要成分为________(填化学式)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3的原因是________。

若溶液中KClO3的含量为100 g·L-1,从该溶液中尽可能多地析出KClO3固体的方法是_______________________________。
【答案】CaC2+2H2O = C2H2↑ +Ca(OH)2 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O B 3Ca(ClO)2===2CaCl2+Ca(ClO3)2 CaCO3、Ca(OH)2 四种离子组合成的四种盐中KClO3的溶解度最小 蒸发浓缩、冷却结晶
【解析】
(1)①电石为碳化钙,与H2O反应生成氢氧化钙和乙炔,化学方程式为CaC2+2H2O = C2H2↑ +Ca(OH)2;氯气和氢氧化钙反应生成Ca(ClO)2的化学方程式为:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O;综上所述,本题答案是:CaC2+2H2O = C2H2↑ +Ca(OH)2 ;2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。
②A项,适当减缓通入Cl2的速率,可以使Cl2反应得更加完全,提高转化率,故不选A项;
B项,充分搅拌浆料可增大反应物间的接触面积,提高转化率,故选B项;
C项,由于Ca(OH)2的溶解度小,加水使Ca(OH)2完全溶解,则会促进2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O的发生,不利于Ca(ClO3)2的生成,故不选C项;
综上所述,本题正确答案为B。
(2)氯化过程中Cl2转化为Ca(ClO3)2为氧化还原反应,反应方程式为:6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O;Ca(ClO)2发生歧化反应,生成Ca(ClO3)2和CaCl2;反应方程式为:3Ca(ClO)2===2CaCl2+Ca(ClO3)2;碳酸钙不溶于水,与氯气不反应,氢氧化钙微溶,因此滤渣的主要成分为CaCO3、Ca(OH)2;综上所述,本题答案是:3Ca(ClO)2===2CaCl2+Ca(ClO3)2 ;CaCO3、Ca(OH)2 。
(3) 由图中的溶解度可知,KClO3溶解度受温度影响较大,而Ca(ClO3)2溶解度受温度影响较小,所以采用蒸发浓缩,冷却结晶的方法获得KClO3固体;综上所述,本题答案是:四种离子组合成的四种盐中KClO3的溶解度最小;蒸发浓缩、冷却结晶。

【题目】Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的相对分子质量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
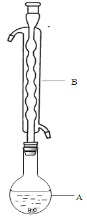
④滤液在经过______________、_____________后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________,其作用是____________________,加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④应采取的操作是_________________、________________。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是___________。如果滤液中该杂质的含量不很低,其检测的方法是:______________________________。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用__________(填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 30.52 |
第二次 | 0.36 | 31.06 |
第三次 | 1.10 | 31.28 |
则所得产品的纯度为______________________________,你认为影响纯度的主要原因是(不考虑操作引起误差)_________________________________。