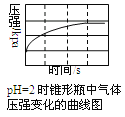
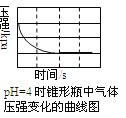
题目内容
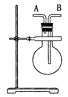
【题目】(1)依据反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。

①电极X的材料是_________________;
②外电路中的电子是从___电极流向__电极(填电极材料名称或符号)。
③在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是___________(填离子符号)。
(2)①金属腐蚀一般可分为化学腐蚀和电化学腐蚀。炒过菜的铁锅未及时清洗容易发生电化学腐蚀而生锈。请写出铁锅生锈过程的正极反应式:____________________。
②为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用__________(填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
③图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的____极。
(3)蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2+ Fe + 2H2O![]() Fe(OH)2+ Ni(OH)2。
Fe(OH)2+ Ni(OH)2。
①若此蓄电池放电时,该电池某一电极发生还原反应的物质是__(填序号)。
A.NiO2B.Fe C.Fe(OH)2D.Ni(OH)2
②该电池放电时,正极附近溶液的pH________(填增大、减小、不变)
③充电时该电池阳极的电极反应式___________________________。
【答案】Cu 铜 银 Cl- O2+2H2O+4e-=4OH- C 负 A 增大 Ni(OH)2-2e-+2OH-=NiO2+2H2O
【解析】
(1)依据反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池,则Cu作负极,Ag作正极,故X电极材料为Cu;外电路电子由铜电极流向银电极;负极反应:Cu-2e-=Cu2+,故盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是Cl-;
(2)炒过菜的铁锅未及时清洗容易发生电化学腐蚀主要是吸氧腐蚀,铁作负极:2Fe—4e—=2Fe2+,C作正极:O2+2H2O+4e-=4OH-,为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,为牺牲阳极的阴极保护法,则焊接在铁闸门上的固体材料R的金属性强于铁,但不能与水反应,故只能选C项;丙所示方案也可以减缓铁闸门的腐蚀速率,为外接电源的阴极保护法,则铁闸门应连接直流电源的负极相接,作阴极;
(3)蓄电池反应原理NiO2+ Fe + 2H2O![]() Fe(OH)2+ Ni(OH)2可知放电时Fe作负极失电子被氧化:Fe—2e—+2 OH-=Fe(OH)2,NiO2得电子被还原发生还原反应;NiO2+2e-+2H2O= Ni(OH)2+2OH-,故正极附近溶液的pH增大;充电时该电池的正极做阳极电极反应式Ni(OH)2-2e-+2OH-=NiO2+2H2O。
Fe(OH)2+ Ni(OH)2可知放电时Fe作负极失电子被氧化:Fe—2e—+2 OH-=Fe(OH)2,NiO2得电子被还原发生还原反应;NiO2+2e-+2H2O= Ni(OH)2+2OH-,故正极附近溶液的pH增大;充电时该电池的正极做阳极电极反应式Ni(OH)2-2e-+2OH-=NiO2+2H2O。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】化合物G的合成路线如下:
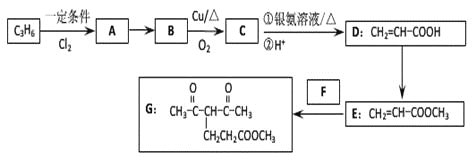
(1)D中含氧官能团的名称为_________,1 molG发生加成反应最多消耗_______mol H2 。
(2)去掉E中含有少量D的试剂和操作是________________________________________;下列有关E的说法正确的是_____________(填字母序号)。
A.可发生氧化反应 | B.催化条件下可发生缩聚反应 |
C.可发生取代反应 | D.是CH2=CHCOOCH2CH3的同系物 |
E.易溶于水
(3)写出A→B的化学反应方程式:________________________________________
(4)反应E + F→G属于下列麦克尔加成反应类型,则F的结构简式为______________________。
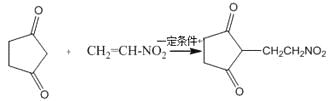
(5)比G少2个氢原子的物质具有下列性质:任写一种该物质的结构简式_________________。
①遇FeCl3溶液显紫色; ②苯环上的一氯取代物只有一种;
③1mol物质最多可消耗2mol Na和1mol NaOH。