题目内容
【题目】用如图所示装置进行实验,将A逐滴加入B中。
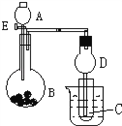
a.若B为Na2CO3粉末,C为C6H5ONa溶液,实验中观察到小试管内溶液由澄清变浑浊,则试管C中化学反应的离子方程式__________;然后往烧杯中加入沸水,可观察到试管C中的现象_______;
b.若B是生石灰,观察到C溶液中先形成沉淀,然后沉淀溶解.当沉淀完全溶解,恰好变澄清时,关闭E.然后往小试管中加入3滴乙醛,再往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是_____________(填名称),C是_______(填化学式).与乙醛溶液混合后,该溶液中反应的化学方程式________;仪器D在此实验中的作用是______。
【答案】 C6H5O﹣+H2O+CO2=C6H5OH+HCO3﹣ 浑浊变澄清 氨水 AgNO3 CH3CHO+2[Ag(NH3)2]OH![]() CH3COONH4+2Ag↓+3NH3+H2O 防止倒吸
CH3COONH4+2Ag↓+3NH3+H2O 防止倒吸
【解析】试题分析:a.若B为Na2CO3粉末,C为C6H5ONa溶液,实验中观察到小试管内溶液由澄清变浑浊,说明有苯酚生成。由此可推断,A可能为稀硫酸,与碳酸钠反应后生成了二氧化碳,二氧化碳通入苯酚钠溶液后与其反应生成了苯酚,苯酚常温下在水中的溶解度很小,所以得到浊液,试管C中发生反应的离子方程式为C6H5O﹣+H2O+CO2=C6H5OH+HCO3﹣;然后往烧杯中加入沸水,因为苯酚在65℃以上可以与水以任意比互溶,所以可观察到试管C中的现象浑浊变澄清;b.若B是生石灰,观察到C溶液中先形成沉淀,然后沉淀溶解.当沉淀完全溶解,恰好变澄清时,关闭E.然后往小试管中加入3滴乙醛,再往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,说明发生了银镜反应,则A是氨水,氨水与生石灰作用生成氨气(生石灰与水反应放出大量的热促使一水合氨分解生成氨气),C是硝酸银溶液(化学式为AgNO3),氨气通入硝酸银溶液先生成氢氧化银沉淀,然后沉淀又溶于氨水得到银氨溶液,与乙醛溶液混合后加热,发生了银镜反应,该溶液中反应的化学方程式CH3CHO+2[Ag(NH3)2]OH![]() CH3COONH4+2Ag↓+3NH3+H2O;氨气极易溶于水,所以仪器D在此实验中的作用是防止倒吸。
CH3COONH4+2Ag↓+3NH3+H2O;氨气极易溶于水,所以仪器D在此实验中的作用是防止倒吸。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下。
2P(s)+3Cl2(g)=2PCl3(g) ΔH=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ΔH=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为________.
(2)不同温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
则ΔH1______0(填“<”“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mol/L,则CO的平衡转化率为______。
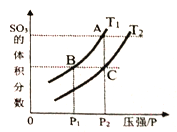
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
A.SO2和SO3浓度相等
B.容器中混合气体的密度保持不变
C.容器中气体的温度保持不变
D.SO3的生成速率与SO2的消耗速率相等
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1____T2 (填“>”或“<");理由是_____。如果想加快正反应的速率,除了改变温度,还可以用_______方法。