题目内容
【题目】工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:

已知:①菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。
②Al3+、Fe3+沉淀完全的pH分别为4.7、3.2,Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③焙烧过程中主要反应为MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。
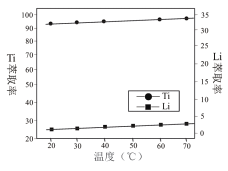
(1)结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、![]() 分别为_____、_____、_______。
分别为_____、_____、_______。

(2)对浸出液净化除杂时,需先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围为_______,将Fe3+和Al3+变为沉淀而除去,然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为______________。
(4)上述流程中可循环使用的物质是________。
(5)现用滴定法测定浸出液中Mn2+的含量。实验步骤:称取1.000 g试样,向其中加入稍过量的磷酸和硝酸,加热使反应2Mn2++![]() +4
+4![]() +2H+
+2H+![]() 2[Mn(PO4)2]3+
2[Mn(PO4)2]3+![]() +H2O充分进行;加入稍过量的硫酸铵,发生反应
+H2O充分进行;加入稍过量的硫酸铵,发生反应![]() +
+![]()
![]() N2↑+2H2O以除去
N2↑+2H2O以除去![]() ;加入稀硫酸酸化,用2.00 mol·L110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3+Fe2+
;加入稀硫酸酸化,用2.00 mol·L110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3+Fe2+![]() Mn2++ Fe3++2
Mn2++ Fe3++2![]() ;用0.10 mol·L110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
;用0.10 mol·L110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________(还原产物是Cr3+)。
②试样中锰的质量分数为_______。
【答案】 500 ℃ 60min 1.10 4.7≤pH<8.1 Mn2++2![]()
![]() MnCO3↓+ CO2↑+H2O NH4Cl 6Fe2++
MnCO3↓+ CO2↑+H2O NH4Cl 6Fe2++![]() +14H+
+14H+![]() 6Fe3++2Cr3++7H2O 77%
6Fe3++2Cr3++7H2O 77%
【解析】
本题考查无机化工流程,意在考查考生分析和解决化学问题的能力。(1)随着温度的升高,锰浸出率逐渐升高,但是500 ℃以后,锰浸出率增加缓慢,并且在500 ℃时,锰浸出率已超过95%。从节约能源的角度考虑,焙烧温度取500 ℃即可;焙烧时间为60 min时锰浸出率较大,超过60 min锰浸出率趋于平缓,因此,实验选择最佳的焙烧时间为60 min;当氯化铵与菱锰矿粉质量比为1.10∶1时,锰浸出率已经很高,继续增加氯化铵用量,锰浸出率提高不明显,因此,氯化铵与菱锰矿粉最佳质量比为1.10∶1。(2)Fe3+和Al3+完全沉淀的pH分别是3.2、4.7,调节pH不能使Mn2+沉淀,所以pH的范围是4.7≤pH<8.1。(3)根据流程,净化除杂或焙烧后,Mn以+2价形式存在,加入碳酸氢铵溶液,发生Mn2++2![]()
![]() MnCO3↓+ CO2↑+H2O。(4)蒸发浓缩、冷却结晶后得到的氯化铵可以循环使用。(5)①Cr2O72-具有强氧化性,能把Fe2+氧化成Fe3+,本省被还原成Cr3+,然后采用化合价升降进行配平,离子反应方程式为:6Fe2++
MnCO3↓+ CO2↑+H2O。(4)蒸发浓缩、冷却结晶后得到的氯化铵可以循环使用。(5)①Cr2O72-具有强氧化性,能把Fe2+氧化成Fe3+,本省被还原成Cr3+,然后采用化合价升降进行配平,离子反应方程式为:6Fe2++![]() +14H+
+14H+![]() 6Fe3++2Cr3++7H2O。②首先根据关系式6Fe2+~
6Fe3++2Cr3++7H2O。②首先根据关系式6Fe2+~![]() 计算出过量的Fe2+为0.006 0 mol,然后得出与[Mn(PO4)2]3反应的Fe2+为0.020 0 mol0.006 0 mol=0.014 mol,根据关系式Mn2+~[Mn(PO4)2]3~Fe2+计算得出n(Mn2+)=0.014 mol,试样中的m(Mn)=0.014 mol×55 g·mol1=0.77 g,故试样中锰的质量分数为77%。
计算出过量的Fe2+为0.006 0 mol,然后得出与[Mn(PO4)2]3反应的Fe2+为0.020 0 mol0.006 0 mol=0.014 mol,根据关系式Mn2+~[Mn(PO4)2]3~Fe2+计算得出n(Mn2+)=0.014 mol,试样中的m(Mn)=0.014 mol×55 g·mol1=0.77 g,故试样中锰的质量分数为77%。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案