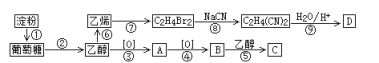
题目内容
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取其工艺流程如图所示.
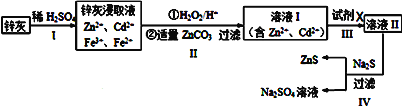
(1)步骤Ⅱ所得滤渣中的物质是(写化学式)_____________。
(2)步骤II中的氧化还原反应的离子方程式为___________________________________。
(3)步骤Ⅳ还可以回收Na2SO4来制取Na2S。Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取,化学反应方程式为__________________________。
(4)已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图:
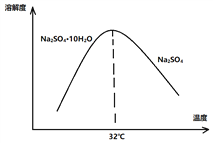
从滤液中得到Na2SO4的操作方法是_________________________________。
(5)在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 molL-1 Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.010 -4 molL-1时,Mn2+开始沉淀,则a=____________。[已知:H2S 的电离常数Ka1=1.310 -7,Ka2=7.010 -15;Ksp(MnS)=1.410 -15]
【答案】 Fe(OH)3 2Fe2++2H++H2O2=2Fe3++2H2O Na2SO4+CH4 ![]() Na2S+CO2+2H2O 蒸发浓缩,在高于32℃的条件下趁热过滤,洗涤,干燥 5
Na2S+CO2+2H2O 蒸发浓缩,在高于32℃的条件下趁热过滤,洗涤,干燥 5
【解析】(1)根据上面的分析可知,步骤Ⅱ所得滤渣中的物质是Fe(OH)3,故答案为:Fe(OH)3
(2)步骤Ⅱ中双氧水将亚铁离子氧化为铁离子,离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O
(3)等物质的量的Na2S04和CH4在高温、催化剂条件下生成Na2S,根据元素守恒可知,该化学反应方程式为Na2SO4+CH4 ![]() Na2S+CO2+2H2O
Na2S+CO2+2H2O
(4)根据溶解度随温度变化曲线可知,从滤液中得到Na2SO4.10H2O的操作方法是:蒸发浓缩,在高于32℃的条件下趁热过滤,洗涤,干燥。
(5)当Qc=Ksp(MnS)时开始沉淀,调节溶液的pH=a,H2S电离常数:K2=7.0×1015,HS浓度为1.0×104molL1时,则![]() ,则
,则![]() ,则c(S2)=7×10a19molL1,所以Ksp=c(Mn2+)c(S2)=7×10a19molL1×0.020molL1=1.4×1015解得a=5,故答案为:5。
,则c(S2)=7×10a19molL1,所以Ksp=c(Mn2+)c(S2)=7×10a19molL1×0.020molL1=1.4×1015解得a=5,故答案为:5。

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案