��Ŀ����
����Ŀ��(1)�ֱ�ȡm g�ơ������������������ᷴӦ������ͬ�����²����������������____________________��
(2)�ֱ�ȡ0.1 mol �ơ������������������ᷴӦ������ͬ�����²����������������________________________��
(3)��������0.25 mol�������������ơ�����������������________________________��
(4)��������ͬ���(ͬ��ͬѹ)�������������ơ����������ֽ��������ʵ���֮����________________________��
(5)��������ͬ�������������ơ����������ֽ���ת�Ƶ��ӵ����ʵ���֮����________________________________��
���𰸡�![]() 1:2:3 23:28:9 6:3:2 1:1:1
1:2:3 23:28:9 6:3:2 1:1:1
��������
�����漰���Ļ�ѧ����ʽ�Т�2Na+2HCl=2NaCl+H2������Fe+2HCl=FeCl2+H2������2Al+6HCl=2AlCl3+3H2�������ݸ���Ӧ������ʵ�����ϻ�ѧ����ʽ���㡣
(1)�ơ��������ڷ�Ӧ�зֱ�ʧȥ1��2��3�����ӣ�mg�ơ������������ʵ����ֱ�Ϊ![]() mol��
mol��![]() mol��
mol��![]() mol���ɵ��ӵ�ʧת���غ�ɵã�2 mol������1 mol������1 mol������1 mol������2 mol������3 mol�������������������������Ϊ
mol���ɵ��ӵ�ʧת���غ�ɵã�2 mol������1 mol������1 mol������1 mol������2 mol������3 mol�������������������������Ϊ![]() mol:
mol:![]() mol:
mol:![]() mol��
mol��![]() ��
��
(2)�ֱ�ȡ0.1mol�ơ����������������ᷴӦ����2Na+2HCl=2NaCl+H2����Fe+HCl=FeCl2+H2����2Al+6HCl=AlCl3+3H2����������ͬ�����²��������������=0.05mol��0.1mol��0.15mol=1��2��3��
(3)��������0.25 mol����������2Na+2HCl=2NaCl+H2����Fe+HCl=FeCl2+H2����2Al+6HCl=AlCl3+3H2�����������ơ������������ʵ���֮��=0.25mol��2��0.25mol��0.25��![]() mol=6��3��2����������=6��23��3��56����2��27=23��28��9��
mol=6��3��2����������=6��23��3��56����2��27=23��28��9��
(4)��������ͬ�����ͬ��ͬѹ�£���H2���������֮������Ӧ�����ʵ���֮�ȣ����趼��1mol�����ݷ�Ӧ2Na+2HCl=2NaCl+H2����Fe+HCl=FeCl2+H2����2Al+6HCl=AlCl3+3H2������������ơ�þ�������ʵ�����Ϊ2��1��![]() =6��3��2��
=6��3��2��
(5)�ӵ�ʧ���ӵĽǶȿ��ǣ�2��H+�õ�������������1��H2��H+�õ��ĵ��ӣ��ɻ��ý����ṩ����������ͬ���������������ơ����������ֽ���ת�Ƶ��ӵ����ʵ�����ȣ����ơ����������ֽ���ת�Ƶ��ӵ����ʵ���֮����1:1:1��

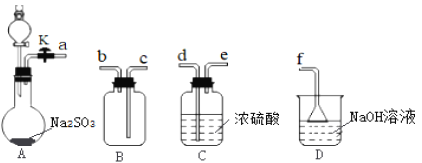
����Ŀ��ij����С��������CuO��NH3��Ӧ���о�NH3��ij�����ʲ��ⶨ����ɣ����������ʵ��װ��(�г�װ��δ����)����ʵ�顣��ش��������⣺

(1)����a������Ϊ____������b�п�ѡ����Լ�Ϊ____��
(2)ʵ������,����װ��A��������ȡ����ɫ������____(����ĸ)��
A��Cl2 | B��O2 | C��CO2 | D��NO2 |
(3)ʵ���й۲쵽װ��C�к�ɫCuO��ĩ��Ϊ��ɫ���壬����������ɫ��ζ�������������������֤��NH3����____��,д����Ӧ�Ļ�ѧ����ʽ:_______________________��
(4)Eװ����Ũ�����������_____________________________________��
(5)��ȡ�������ǰ��Ӧ��װ��F���еIJ�����____________________________��
(6)ʵ����ϣ�����ø����D����m g��װ��F�����������Ϊn L��������ɱ�״�����������е������ԭ�Ӹ�����Ϊ____���ú�m��n��ĸ�Ĵ���ʽ��ʾ����