��Ŀ����
����Ŀ����ҵ�Ʋ�����Ҫԭ����ʯӢ�������ʯ��ʯ���ڲ���Ҥ�з�����Ҫ��Ӧ�Ļ�ѧ����ʽΪ�� ��Na2CO3+SiO2 ![]() Na2SiO3+CO2����
Na2SiO3+CO2����
��CaCO3+SiO2 ![]() CaSiO3+CO2��
CaSiO3+CO2��
��1����Ӧ���У����ƻ������������������ѡ���ţ��� a�����»��� b�����Ӽ� c�����ۼ�
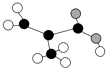
��2������������Ӧ�ķ�Ӧ����������У��漰���IJ�ͬ���͵ľ������֣������֣��������۷е���͵Ļ�����ĵ���ʽΪ���û������۷е����CS2��ԭ���� ��
��3�������еĽ��������ӵİ뾶�������Ӱ뾶�����С������ʯ��ʯ�еĽ��������ӵĵ�����ռ�ݵĵ��Ӳ��У�������ߵ����㣨����Ӳ���š�����
��4����֪10g̼�����ȫ�ֽ⣬������17.56KJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
���𰸡�
��1��bc
��2��3�� ![]() �����߶�Ϊ���Ӿ���,�ҽṹ����,CS2ʽ������CO2,CS2���»�����,��CS2�۷е����CO2
�����߶�Ϊ���Ӿ���,�ҽṹ����,CS2ʽ������CO2,CS2���»�����,��CS2�۷е����CO2
��3���� M
��4��CaCO3��s��=CaO��s��+CO2��g����H=+175.6 KJ/mol
���������⣺��1��Na2CO3+SiO2 ![]() Na2SiO3+CO2������Ӧ�У����ƻ�������������������Ӽ����ۼ���
Na2SiO3+CO2������Ӧ�У����ƻ�������������������Ӽ����ۼ���
���Դ��ǣ�bc����2����Na2CO3+SiO2 ![]() Na2SiO3+CO2���� ��CaCO3+SiO2
Na2SiO3+CO2���� ��CaCO3+SiO2 ![]() CaSiO3+CO2����������Ӧ��̼���ơ�̼��ơ��������Լ�������������Ӿ��壬������̼���ڷ��Ӿ��壻������������ԭ�Ӿ��壻���Ӿ�����۵�С��ԭ�Ӿ�������Ӿ��壬���Զ�����̼�۷е���ͣ�������̼�ĵ���ʽΪ
CaSiO3+CO2����������Ӧ��̼���ơ�̼��ơ��������Լ�������������Ӿ��壬������̼���ڷ��Ӿ��壻������������ԭ�Ӿ��壻���Ӿ�����۵�С��ԭ�Ӿ�������Ӿ��壬���Զ�����̼�۷е���ͣ�������̼�ĵ���ʽΪ ![]() �����Ӿ������Է�������Խ���»������۷е�Խ�ߣ�CO2��CS2��Ϊ���Ӿ��壬�ҽṹ���ƣ�CS2ʽ������CO2��CS2���»���������CO2�۷е����CS2��
�����Ӿ������Է�������Խ���»������۷е�Խ�ߣ�CO2��CS2��Ϊ���Ӿ��壬�ҽṹ���ƣ�CS2ʽ������CO2��CS2���»���������CO2�۷е����CS2��
���Դ��ǣ�3�� ![]() �����߶�Ϊ���Ӿ��壬�ҽṹ���ƣ�CS2ʽ������CO2��CS2���»�����CS2�۷е����CO2����3��ͬ���ڴ����������Ӱ뾶��С���������ӵİ뾶���������ӣ�ʯ��ʯ��������Ϊ�����ӣ������Ӻ������������Ӳ㣬�����ΪM�㣬��������ߵ���M��
�����߶�Ϊ���Ӿ��壬�ҽṹ���ƣ�CS2ʽ������CO2��CS2���»�����CS2�۷е����CO2����3��ͬ���ڴ����������Ӱ뾶��С���������ӵİ뾶���������ӣ�ʯ��ʯ��������Ϊ�����ӣ������Ӻ������������Ӳ㣬�����ΪM�㣬��������ߵ���M��
���Դ��ǣ���M����4��10g̼��Ƶ����ʵ���Ϊ0.1mol����ȫ�ֽ⣬������17.56KJ����������1mol̼��Ʒֽ�����175.6 KJ���������Ȼ�ѧ����ʽΪ��CaCO3��s��=CaO��s��+CO2��g����H=+175.6 KJ/mol��
���Դ��ǣ�CaCO3��s��=CaO��s��+CO2��g����H=+175.6 KJ/mol��

 ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�