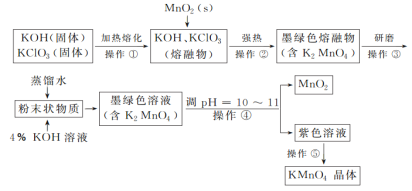
题目内容
【题目】下列物质 ①Cu;②液态SO2;③纯醋酸;④NaHCO3;⑤Ba(OH)2溶液;⑥酒精。
I.属于非电解质的是_______________________;(填序号)
Ⅱ.(1)NaHCO3是一种 _________________(填“强”或“弱”)电解质;
(2)写出HCO3-水解的离子方程式:_____________________________________;
(3)常温下,0.1 mol/LNaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为:________________________。
III.Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
(1)该Ba(OH)2溶液的物质的量浓度为___________________;
(2)溶液中由水电离出c(OH-)=______________;
(3)与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
【答案】②⑥ 强 HCO3-+H2O![]() H2CO3+OH- c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-) 0.05 mol/L 1.0×10-13 mol/L 2
H2CO3+OH- c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-) 0.05 mol/L 1.0×10-13 mol/L 2
【解析】
I.水溶液中和熔融状态都不导电的化合物称为非电解质;
Ⅱ.(1)在溶液中能够完全电离的电解质为强电解质,不能完全电离的为弱电解质;
(2)HCO3-水解生成碳酸和氢氧根离子;
(3)0.1 mol/LNaHCO3溶液的pH大于8,说明碳酸氢根离子的水解程度大于电离程度;
Ⅲ.(1)Ba(OH)2是一种强电解质,完全电离,1 mol Ba(OH)2电离产生2 mol OH-,所以c(OH-)=2c[Ba(OH)2],据此解答;
(2)Ba(OH)2溶液中氢离子都是由水电离产生,水电离产生的c(OH-)等于溶液中水电离出c(H+);
(3)设盐酸的物质的量浓度为:c(HCl),碱与酸体积分别为1 L、9 L,分别求出氢氧化根离子和氢离子的物质的量,二者发生酸碱中和,所得溶液pH=11可知碱剩余,求出剩余的氢氧根离子的物质的量,依据:Kw= c(H+)·c(OH-)计算解答。
I.①Cu是金属单质,不属于电解质,也不属于非电解质;
②液态SO2由分子构成,在水溶液反应产生的H2SO3电离产生离子而导电,SO2不能电离产生离子,在熔融状态也不能电离,因此是不导电的化合物,属于非电解质;
③纯醋酸由分子构成,在水中能够电离产生自由移动的离子而导电,属于电解质;
④NaHCO3、⑤Ba(OH)2都是离子化合物,在水溶液中或熔融状态下能够导电属于电解质;
⑥酒精由分子构成,在水溶液或熔融状态下都不能够电离产生自由移动的离子,因此属于非电解质;
故属于非电解质的物质序号为②⑥;
Ⅱ.(1)NaHCO3是盐,在溶液中能够完全电离的电解质,属于强电解质;
(2)HCO3-水解,消耗水电离产生的H+,生成碳酸和氢氧根离子,水解的离子方程式为:HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
(3)常温下,0.1 mol/LNaHCO3溶液的pH大于8,c(OH-)>c(H+),说明HCO3-水解程度大于其电离程度,HCO3-由于水解和电离而消耗,则c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),但盐水解程度是微弱的,主要以盐电离产生的离子存在,所以c(HCO3-)>c(H2CO3)、c(HCO3-)> c(OH-),溶液中氢氧根来源于水的电离与HCO3-水解,则c(OH-)>c(H2CO3),因此溶液中微粒浓度关系为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-);
Ⅲ.(1)pH=13的Ba(OH)2溶液,c(H+)=10-13 mol/L,c(OH-)=![]() =0.1 mol/L,所以c[Ba(OH)2] =0.5×c(OH-)=0.05 mol/L;
=0.1 mol/L,所以c[Ba(OH)2] =0.5×c(OH-)=0.05 mol/L;
(2)pH=13的Ba(OH)2溶液中氢离子全部由水电离产生,又因为由水电离出c(OH-)与由水电离产生c(H+)相等,故水电离出c(OH-)= c(H+)=10-13 mol/L;
(3)设盐酸的物质的量浓度为c(HCl),碱与酸体积分别为1 L、9 L,则n(OH-)=0.1mol/L×1 L=0.1 mol,n(H+)=c(HCl)×9 L,反应后剩余氢氧根离子的物质的量为:0.1 mol-c(HCl)×9 L;
由混合所得溶液pH=11,可知混合后c(H+)=10-11 mol/L,则混合后c(OH-)=![]() =10-3 mol/L,即:
=10-3 mol/L,即:![]() =10-3 mol/L,解得:c(HCl)=10-2 mol/L,根据pH=-lg c(H+),所以HCl溶液的pH=2。
=10-3 mol/L,解得:c(HCl)=10-2 mol/L,根据pH=-lg c(H+),所以HCl溶液的pH=2。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案