题目内容
【题目】羟基磷酸钙[Ca10(PO4)6(OH)2]具有优良的生物相容性和生物活性,它在口腔保健中具有重要作用,可以防止龋齿等,回答下列问题。
(1)Ca10(PO4)6(OH)2中,元素的电负性按由大到小的顺序依次是___。
(2)上述元素都能形成氢化物,其中PH3与同主族元素N形成的氢化物的沸点是PH3___NH3(填“>”或“<”),原因是___。
(3)碳酸钙的分解温度远高于碳酸镁,其原因是__。
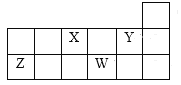
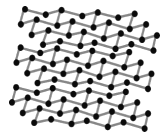
(4)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示:其中最小的环为6元环,每个环平均含有__个P原子。
【答案】O>P>H>Ca < 氨分子间形成氢键,使熔沸点较高 镁离子半径小于钙离子半径,与氧离子形成的离子键更强,晶格能更大,因此碳酸镁的热分解温度低 2
【解析】
Ca10(PO4)6(OH)2中含有Ca、O、P、H四种元素,PH3与NH3的空间构型均为三角锥形;钙离子的半径大于镁离子;黑磷中最小的环为六元环,由图可知每个磷原子被3个环共用。
(1)同周期从左到右、同主族从下到上元素的电负性逐渐变大,Ca、O、P、H四种元素的电负性由大到小的顺序为O>P>H>Ca。
(2)氨分子间形成氢键,使熔沸点较高,故PH3的沸点小于NH3。
(3)由MgCO3和CaCO3都为离子晶体,MgCO3和CaCO3离子所带电荷相等,由于Mg2+半径小于Ca2+半径,所以MgO晶格能大于CaO晶格能,所以Mg2+比Ca2+更易与碳酸根离子中的氧离子结合,使碳酸根离子分解为CO2。
(4)黑磷与石墨烯相似,其中最小的环为六元环,由图可知每个磷原子被3个环共用,故每个环平均含有![]() 个P原子。
个P原子。

 阅读快车系列答案
阅读快车系列答案【题目】(1)下表是不同温度下水的离子积数据:
温度/℃ | 25 | T1 | T2 |
Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
试回答以下几个问题:
①已知25℃< T1< T2 ,在T1时,水中 c(H+)______c(OH-), 则a_____1×10-14(填“<”、“>”或“=”)。
②在T2下,将pH=1的H2SO4溶液V1 L与pH=11的NaOH溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 =_________。
(2)常温下,将0.01 mol/L的CH3COOH溶液体积Va与0.01 mol/L的NaOH溶液体积Vb混合,已知:CH3COOH稀溶液的电离平衡常数为Ka=2×10-5。
a. Va=Vb时,等体积混合后测得溶液为碱性,原因是:_____(用离子方程式解释),该平衡的平衡常数Kh=_________。
b.混合后溶液的pH=7,则Va ____Vb(填“<”、“>”或“=”);该混合溶液中离子浓度由大到小的排列:______。
c.常温条件下,pH=11的CH3COONa溶液,由水电离出的c(OH-)=___________。