题目内容
【题目】工业上曾经通过反应“3Fe+4NaOH ![]() Fe3O4+2H2↑4Na↑”生产金属钠,己知铁的熔点1535℃、沸点3000℃。下列有关说法正确的是
Fe3O4+2H2↑4Na↑”生产金属钠,己知铁的熔点1535℃、沸点3000℃。下列有关说法正确的是
A.增大铁的量可以使反应速率加快
B.将生成的气体在空气中冷却可获得钠
C.每生成1molH2,转移的电子数约为4×6.02×1023
D.该反应条件下铁的金属性比钠强
【答案】C
【解析】
试题分析:A.铁是固体,改变固体的质量反应速率不变,A错误;B.钠是活泼金属,很容易被空气中氧气氧化,所以不能将生成的气体在空气中冷却,B错误;C.根据方程式可知,每生成2molH2,转移的电子8mol,所以每生成1molH2,转移的电子数约为4×6.02×1023,C正确;D.根据方程式3Fe + 4NaOH ![]() Fe3O4 + 2H2↑ + 4Na↑可知,该反应中铁元素的化合价升高,做还原剂,说明该反应条件下铁的还原性比钠强,D错误,答案选C。
Fe3O4 + 2H2↑ + 4Na↑可知,该反应中铁元素的化合价升高,做还原剂,说明该反应条件下铁的还原性比钠强,D错误,答案选C。

【题目】在气体分析中,常用CuCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2CuCl+2CO+2H2O=Cu2Cl22CO2H2O。
回答下列问题:
(1)Cu在元素周期表中属于______(选填“s”、“p”、“d”或“ds”)区元素。研究人员发现在高温超导材料镧钡铜氧化物中含有Cu3+,基态Cu3+的电子排布式为______。
(2)C、N、O三种原子中的第一电离能最大的是______。NO3-离子的空间构型是______。
(3)CO与N2互称等电子体。
①它们的分子中都存在三个共价键,其中包含______个σ键,______个π键。
②下表为CO和N2的有关信息。
键的类型 | A-B(单键) | A=B(双键) | A≡B(叁键) | |
键能(kJ/mol) | CO | 351 | 803 | 1071 |
N2 | 159 | 418 | 946 | |
根据表中数据,说明CO比N2活泼的原因是______。
(4)Cu2Cl22CO2H2O是一种配合物,其结构如图所示:
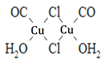
①该配合物中氯原子的杂化方式为______。
②该配合物中,CO作配体时配位原子是C而不是O的原因是______。
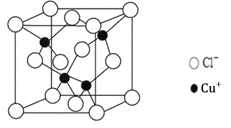
(5)阿伏加德罗常数的测定有多种方法,X射线衍射法就是其中的一种。通过对CuCl晶体的X射线衍射图象分析,可以得出CuCl的晶胞如图所示,则距离每个Cu+最近的Cl-的个数为______。若晶体中Cl-呈立方面心最密堆积方式排列,Cl-的半径为a pm,晶体的密度为ρg/cm3,阿伏加德罗常数NA=______(列计算式表达)。