题目内容
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
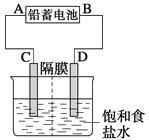
已知:铅蓄电池在放电时发生下列电极反应:
负极Pb+SO![]() -2e-===PbSO4
-2e-===PbSO4
正极PbO2+4H++SO![]() +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式_______________________________________。
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为________极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量)时,
①若收集到11.2 L(标准状况下)氯气,溶液pH=_________________。
②若铅蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为___________L。
【答案】 2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ 正 14 22.4
2NaOH+Cl2↑+H2↑ 正 14 22.4
【解析】(1)电解饱和食盐水的化学方程式为2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑;
2NaOH+Cl2↑+H2↑;
(2)C极一侧滴酚酞试液不变红色,说明该极无OH-生成,C极是阳极,故A是正极,故答案为:正;
(3)①标准状况下11.2LCl2的物质的量是0.5mol,每生成1molCl2转移2mole-,故收集到11.2L(标准状况下)氯气,则转移电子为1mole-,根据2H2O+2e- = H2↑+ 2OH―,生成的氢氧根离子的物质的量为1mol,c(OH-)=1 mol/L ,则c(H+)=10-14 mol/L,pH=14,故答案为:14;
②铅蓄电池放电的总反应为Pb+PbO2+2H2SO4═2PbSO4+2H2O,每消耗2molH2SO4,转移2mole-,可生成1molH2,标准状况时,H2的体积为1mol×22.4L/mol=22.4L,故答案为:22.4。

 名校课堂系列答案
名校课堂系列答案【题目】煤化工中常需研究不同温度下的平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:
CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
(1)该反应的平衡常数表达式K=__________。该反应的正反应是______反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,恒容、升高温度,原化学平衡向______反应方向移动(填“正”或“逆”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)能判断该反应是否达到化学平衡状态的依据是(_____)
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)830℃,在恒容反应器中发生如表中的反应,按表中的物质的量投入反应混合物,其中向正反应方向进行的有__________(选填A、B、C、D)
n(CO) | n(H2O) | n(H2) | n(CO2) | |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 3 | 3 | 0 | 0 |
D | 0. | 2 | 1 | 1 |
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
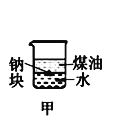
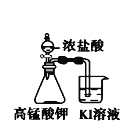
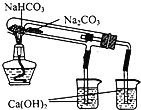
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.20 | a | 0.10 | c | d | e |
c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)表中b_____c(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为_____mol/L,0~20s内N2O4的平均反应速率为_________.
(3)该反应在80℃时该反应的平衡常数K值为_______(保留2位小数).