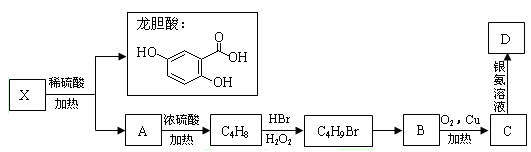
题目内容
以下有关下列三个化学反应的说法不正确的是
①CuO+H2 Cu+H2O②2KCl03
Cu+H2O②2KCl03 2KCl+3o2↑③CaCO3+2HCl=CaCl2+H2O+CO2↑
2KCl+3o2↑③CaCO3+2HCl=CaCl2+H2O+CO2↑
- A.反应①②③都属于氧化还原反应
- B.反应②中氧化剂还原剂均为KClO3,其中氧元素化合价降低
- C.反应①H2作还原剂,在反应中被氧化
- D.反应①中还原性:H2>Cu
AB
分析:有电子转移的化学反应是氧化还原反应,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,氧化剂被还原,还原剂被氧化,同一化学反应中,还原剂的还原性大于氧化产物的还原性.
解答:A.①CuO+H2 Cu+H2O中铜、氢元素化合价都发生变化,所以是氧化还原反应,②2KCl03
Cu+H2O中铜、氢元素化合价都发生变化,所以是氧化还原反应,②2KCl03 2KCl+3O2↑中氧元素、氯元素的化合价都发生变化,所以是氧化还原反应,③CaCO3+2HCl=CaCl2+H2O+CO2↑中各元素的化合价都不变,所以不是氧化还原反应,属于复分解反应,故A错误;
2KCl+3O2↑中氧元素、氯元素的化合价都发生变化,所以是氧化还原反应,③CaCO3+2HCl=CaCl2+H2O+CO2↑中各元素的化合价都不变,所以不是氧化还原反应,属于复分解反应,故A错误;
B.②2KCl03 2KCl+3O2↑中氧元素失电子化合价升高,氯元素得电子化合价降低,所以氯酸钾既是氧化剂又是还原剂,但氧元素化合价升高,故B错误;
2KCl+3O2↑中氧元素失电子化合价升高,氯元素得电子化合价降低,所以氯酸钾既是氧化剂又是还原剂,但氧元素化合价升高,故B错误;
C.①CuO+H2 Cu+H2O中氢元素失电子化合价升高,所以氢气是还原剂,被氧化,故C正确;
Cu+H2O中氢元素失电子化合价升高,所以氢气是还原剂,被氧化,故C正确;
D.①CuO+H2 Cu+H2O中氢气是还原剂,铜是还原产物,所以还原性H2>Cu,故D正确;
Cu+H2O中氢气是还原剂,铜是还原产物,所以还原性H2>Cu,故D正确;
故选AB.
点评:本题考查氧化还原反应,明确元素化合价是解本题关键,注意还原性强弱的判断方法.
分析:有电子转移的化学反应是氧化还原反应,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,氧化剂被还原,还原剂被氧化,同一化学反应中,还原剂的还原性大于氧化产物的还原性.
解答:A.①CuO+H2
 Cu+H2O中铜、氢元素化合价都发生变化,所以是氧化还原反应,②2KCl03
Cu+H2O中铜、氢元素化合价都发生变化,所以是氧化还原反应,②2KCl03 2KCl+3O2↑中氧元素、氯元素的化合价都发生变化,所以是氧化还原反应,③CaCO3+2HCl=CaCl2+H2O+CO2↑中各元素的化合价都不变,所以不是氧化还原反应,属于复分解反应,故A错误;
2KCl+3O2↑中氧元素、氯元素的化合价都发生变化,所以是氧化还原反应,③CaCO3+2HCl=CaCl2+H2O+CO2↑中各元素的化合价都不变,所以不是氧化还原反应,属于复分解反应,故A错误;B.②2KCl03
 2KCl+3O2↑中氧元素失电子化合价升高,氯元素得电子化合价降低,所以氯酸钾既是氧化剂又是还原剂,但氧元素化合价升高,故B错误;
2KCl+3O2↑中氧元素失电子化合价升高,氯元素得电子化合价降低,所以氯酸钾既是氧化剂又是还原剂,但氧元素化合价升高,故B错误;C.①CuO+H2
 Cu+H2O中氢元素失电子化合价升高,所以氢气是还原剂,被氧化,故C正确;
Cu+H2O中氢元素失电子化合价升高,所以氢气是还原剂,被氧化,故C正确;D.①CuO+H2
 Cu+H2O中氢气是还原剂,铜是还原产物,所以还原性H2>Cu,故D正确;
Cu+H2O中氢气是还原剂,铜是还原产物,所以还原性H2>Cu,故D正确;故选AB.
点评:本题考查氧化还原反应,明确元素化合价是解本题关键,注意还原性强弱的判断方法.

练习册系列答案
相关题目
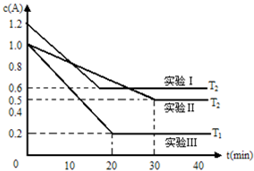 恒容体系,发生如下反应2A(g)?B(g)+xC(?)△H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
恒容体系,发生如下反应2A(g)?B(g)+xC(?)△H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
 所示:
所示: