��Ŀ����
����Ŀ�����ú�̼������ϳ�ȼ���ǽ����ԴΣ������Ҫ��������֪CO(g)��2H2(g)![]() CH3OH(g)��Ӧ�����е������仯�����ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ���� ( )
CH3OH(g)��Ӧ�����е������仯�����ͼ��ʾ�����ߢ�����ߢ�ֱ��ʾ��ʹ�ô�����ʹ�ô�������������������ж���ȷ���� ( )
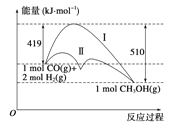
A���÷�Ӧ�Ħ�H����91 kJ��mol��1
B������������÷�Ӧ�Ħ�H��С
C����Ӧ���������С���������������
D������÷�Ӧ����Һ̬CH3OH����H��С
���𰸡�D
��������
���������A������ͼ����Ӧ������������������������������˸÷�Ӧ�Ƿ��ȷ�Ӧ���÷�Ӧ�Ħ�H��-91 kJ��mol��1��A�����B���������ͷ�Ӧ�Ļ�ܣ������ܸı䷴Ӧ�ȣ�B�����C������ͼ��Ӧ����������������������������C�����D��������Һ̬ʱ��������������̬ʱ����������������Һ̬�״����ȶ࣬����Խ������HԽС��D����ȷ����ѡD��

��ϰ��ϵ�д�
�����Ŀ