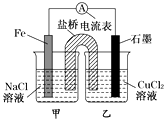
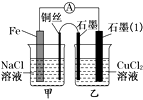
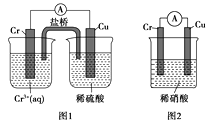
题目内容
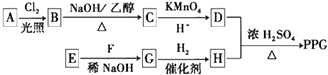
【题目】3﹣对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下: 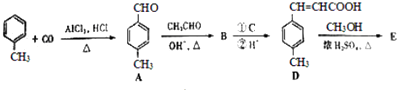
已知:HCHO+CH3CHO ![]() CH2=CHCHO+H2O
CH2=CHCHO+H2O
(1)遇FeCl3溶液显紫色且苯环上有两个取代基的A的同分异构体有种,B中含氧官能团的名称为 .
(2)试剂C可选用下列中的 .
a、溴水
b、银氨溶液
c、酸性KMnO4溶液
d、新制Cu(OH)2悬浊液
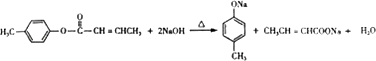
(3)![]() 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 .
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 .
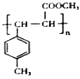
(4)E在一定条件下可以生成高聚物F,F的结构简式为 .
【答案】
(1)3;醛基
(2)bd
(3)
(4)
【解析】解:由合成路线可知,甲苯发生取代反应生成对甲基苯甲醛,再与CH3CHO在碱性条件下反应生成B,B为 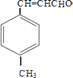 ,①中﹣CHO被弱氧化剂氧化为﹣COOH,而C=C不能被氧化,再酸化得到D
,①中﹣CHO被弱氧化剂氧化为﹣COOH,而C=C不能被氧化,再酸化得到D 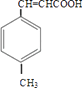 ,D与甲醇发生酯化反应生成E为
,D与甲醇发生酯化反应生成E为 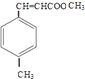 ,(1)遇FeCl3溶液显紫色,则含酚﹣OH,且苯环上有两个取代基,另一取代基为﹣CH=CH2 , 则符合条件的A的同分异构体为邻、间、对乙烯基苯酚3种,B中含氧官能团的名称为醛基,故答案为:3;醛基;(2)试剂C不能与C=C反应,只氧化﹣CHO,则C为b或d,故答案为:b、d;(3)E同分异构体中含﹣COOC﹣,与足量NaOH溶液共热的化学方程式为
,(1)遇FeCl3溶液显紫色,则含酚﹣OH,且苯环上有两个取代基,另一取代基为﹣CH=CH2 , 则符合条件的A的同分异构体为邻、间、对乙烯基苯酚3种,B中含氧官能团的名称为醛基,故答案为:3;醛基;(2)试剂C不能与C=C反应,只氧化﹣CHO,则C为b或d,故答案为:b、d;(3)E同分异构体中含﹣COOC﹣,与足量NaOH溶液共热的化学方程式为 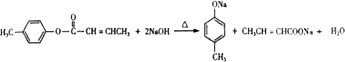 ,故答案为:
,故答案为: 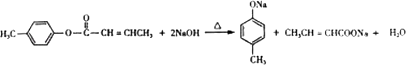 ;(4)E中含C=C,在一定条件下可以生成高聚物F,发生加聚反应,则F的结构简式为
;(4)E中含C=C,在一定条件下可以生成高聚物F,发生加聚反应,则F的结构简式为 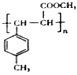 ,故答案为:
,故答案为: 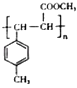 .
.
由合成路线可知,甲苯发生取代反应生成A对甲基苯甲醛,再与CH3CHO在碱性条件下反应生成B,B为 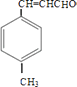 ,①中﹣CHO被弱氧化剂氧化为﹣COOH,而C=C不能被氧化,再酸化得到D
,①中﹣CHO被弱氧化剂氧化为﹣COOH,而C=C不能被氧化,再酸化得到D 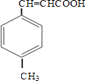 ,D与甲醇发生酯化反应生成E为
,D与甲醇发生酯化反应生成E为 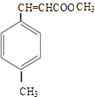 ,然后结合有机物的结构与性质来解答.
,然后结合有机物的结构与性质来解答.

【题目】5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.
阳离子 | Na+ Al3+Fe3+ Cu2+、Ba2+ |
阴离子 | OH﹣ Cl﹣ CO32﹣ NO3﹣ SO4﹣ |
分别取它们的水溶液进行实验,结果如下:①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3 , 沉淀部分溶解,剩余白色固体;②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6molL﹣1稀H2SO4 , Cu逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断A、C的化学式为:A;C .
(2)写出步骤②中发生反应的化学方程式 .
(3)D溶液中滴入石蕊试液,现象是 , 原因是(用离子方程式说明).
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是mL.
(5)现用500mL 3molL﹣1的E溶液充分吸收11.2L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为 .
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水).
【题目】Ⅰ、磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子结构示意图是 .
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10 10C+P4O10═P4+10CO
每生成1mol P4时,就有mol电子发生转移.
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2═C6H6O6+2H++2I﹣ 2S2O32﹣+I2═S4O62﹣+2I﹣
在一定体积的某维生素C溶液中加入a molL﹣1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2 , 消耗b molL﹣1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是mol.
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3﹣+5SO32﹣+2H+═I2+5SO42﹣+H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
0.01molL﹣1 | 0.01molL﹣1 | H2O的体积 | 实验 | 溶液出现蓝色时所需时间/s | |
实验1 | 5 | V1 | 35 | 25 | |
实验2 | 5 | 5 | 40 | 25 | |
实验3 | 5 | 5 | V2 | 0 |
该实验的目的是;表中V2=mL
(5)Ⅱ、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl36H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是 .
(6)在某强酸性混合稀土溶液中加入H2O2 , 调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:Ce3++H2O2+H2O═Ce(OH)4↓+ .