题目内容
13.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )| A. | CO2和SiO2 | B. | NaCl和HCl | C. | CO2和NH3 | D. | CCl4和KCl |
分析 一般来说,活泼金属与非金属形成离子键、非金属之间形成共价键,含离子键的为离子晶体,含共价键的可能为原子晶体或分子晶体,以此来解答.
解答 解:A.均含共价键,分别为分子晶体、原子晶体,故A不选;
B.分别含离子键、共价键,分别为离子晶体、分子晶体,故B不选;
C.均含共价键,均为分子晶体,故C选;
D.分别含共价键、离子键,分别为分子晶体、离子晶体,故D不选;
故选C.
点评 本题考查化学键及晶体类型,为高频考点,把握化学键的形成及判断的一般规律、化学键与晶体类型的关系为解答的关键,侧重分析与应用能力的考查,注意原子晶体的判断为解答的难点,题目难度不大.

练习册系列答案
相关题目
3.下列有关能量转换的说法正确的是( )
| A. | 风力发电是化学能转换为电能 | |
| B. | 动物体内的葡萄糖被氧化成CO2,是热能转换成化学能 | |
| C. | 植物通过光合作用将CO2转化为葡萄糖,是将太阳能转换成热能 | |
| D. | 植物燃烧时放出的能量来源于太阳能 |
4.下列离子方程式正确的是( )
| A. | 碳酸钙溶于盐酸中:CO32-+2H+=H2O+CO2↑ | |
| B. | 澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O | |
| D. | 用氢氧化钠溶液吸收少量二氧化碳:2OH-+CO2=CO32-+H2O |
1.下列离子方程式中,正确的是( )
| A. | 钠和水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 铜跟稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| C. | 向AlCl3溶液中加入过量的氨水溶液:Al3++3OH-=Al(OH)3↓ | |
| D. | 氯气通入冷的氢氧化钠溶液中 2Cl2+2OH-=3Cl-+ClO-+H2O |
8.不能用离子方程式 CO32-+2H+=CO2↑+H2O表示的反应是( )
| A. | Na2CO3+2HCl=2NaCl+CO2↑+H2O | B. | K2CO3+2HNO3=2KNO3+CO2↑+H2O | ||
| C. | K2CO3+H2SO4=K2SO4+CO2↑+H2O | D. | CaCO3+2HCl=CaCl2+CO2↑+H2O |
18.物质的量浓度相同的下列溶液:①醋酸钠 ②硫酸 ③氯化钠 ④硫酸氢钠 ⑤氯化铵 ⑥碳酸氢钠 ⑦氢氧化钠,按pH由小到大的顺序排列的是( )
| A. | ②④⑤③①⑥⑦ | B. | ④②⑤③①⑥⑦ | C. | ②④⑤③⑥①⑦ | D. | ⑦⑥①③⑤④② |
2.在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)?B(g)+C(g)△H=+85.1kJ•mol-1.
回答下列问题:
下表为反应物A浓度与反应时间的数据,计算:a=0.051.
分析该反应中反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是达到平衡前每间隔4h,c(A)减少约一半,由此规律推出反应在12h时反应物的浓度c(A)为0.013mol•L-1.
回答下列问题:
下表为反应物A浓度与反应时间的数据,计算:a=0.051.
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol•L-1) | 0.10 | a | 0.026 | 0.0065 |
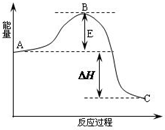 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)放出热量99kJ,请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)放出热量99kJ,请回答下列问题: