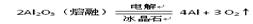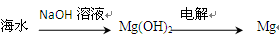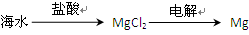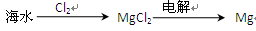题目内容
下列说法中,不正确的是
| A.用蒸馏法能从海水中提取淡水 |
| B.从海水中可以得到氯化镁,再加热分解可制金属镁 |
| C.用氯气从海水中提溴的关键反应是Cl2+2Br-= 2Cl-+Br2 |
D.煤的气化主要反应是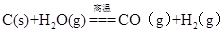 |
B
试题分析:用蒸馏法能从海水中提取淡水,A正确;镁是活泼的金属,电解熔融的氯化镁冶炼金属镁,B不正确;氯气具有强氧化性,能被溴离子氧化生成单质溴,C正确;煤气的 主要成分是氢气和CO,D正确,答案选B。
点评:该题是基础性试题的考查,难度不大。试题紧扣教材,基础性强,主要是考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的学习兴趣和学习积极性。

练习册系列答案
相关题目
 溴蒸气
溴蒸气
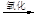
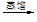 液溴
液溴 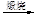
 石灰乳
石灰乳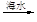
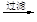
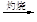 MgO
MgO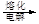 镁
镁
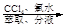 含碘有机溶液
含碘有机溶液
 精盐
精盐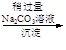
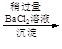
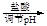
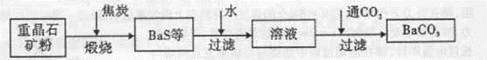
 BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
 2Hg + O2 ↑
2Hg + O2 ↑