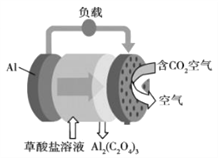
题目内容
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和C原子最外层只有一个电子,C燃烧时的焰色反应是黄色,C的单质在高温下与B的单质充分反应可以产生淡黄色固态化合物,A单质与D单质可以发生化合反应,且反应条件可以是点燃或者光照,试根据以上叙述回答:
(1)写出B、D的元素名称:BD .
(2)写出化学方程式:C+B= ,
(3)C元素离子的离子结构示意图
(4)写出A2B、C2B2的电子式、 .
【答案】
(1)氧;氯
(2)2Na+O2 ![]() Na2O2
Na2O2
(3)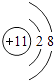
(4)![]() ;
;![]()
【解析】解:A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,A和C原子最外层只有一个电子,说明A和C为第ⅠA族元素,C燃烧时的焰色反应是黄色,则C为Na元素,C的单质在高温下与B的单质充分反应可以产生淡黄色固态化合物,可知B为O元素,生成的淡黄色固体为过氧化钠,A单质与D单质可以发生化合反应,且反应条件可以是点燃或者光照,应为氢气与氯气的反应,则A为H元素,D为Cl元素.(1)由以上分析可知,B、D的元素名称分别为氧、氯, 所以答案是:氧;氯;(2)钠在加热条件下和氧气反应生成过氧化钠,反应方程式为2Na+O2 ![]() Na2O2 ,
Na2O2 ,
所以答案是:2Na+O2 ![]() Na2O2;(3)C钠元素,钠离子的离子结构示意图为
Na2O2;(3)C钠元素,钠离子的离子结构示意图为 ![]() ,
,
所以答案是: 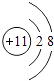 ;(4)H2O的电子式为
;(4)H2O的电子式为 ![]() 、Na2O2的电子式为
、Na2O2的电子式为 ![]() ,
,
所以答案是: ![]() ;
; ![]() .
.

练习册系列答案
相关题目