题目内容
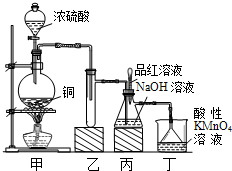 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:(1)装置乙的作用是
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为
(3)SO2气体有漂白性、还原性和氧化性.将SO2通入氯水中,SO2表现的是
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化.现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水.
请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中.
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液.静置一段时间后,得到滤液A和固体B. | / |
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再 |
若品红褪色(或有气泡),则 |
| 步骤3: |
若 则 否则 |
(2)二氧化硫具有还原性,可与酸性高锰酸钾发生氧化还原反应;
(3)二氧化硫可与氯气发生氧化还原反应;
(4)溶液中的NaOH完全转化为了NaHSO3,二氧化硫应过量,滴加品红褪色;
(5)实验探究吸收后产物中是否存在NaHSO3和Na2SO3,可取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液,静置一段时间后,得到滤液A和固体B,往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再滴加盐酸,若品红褪色(或有气泡),则说明含有Na2SO3,然后用试管取少量A,向其中加入过量的氢氧化钡溶液或加入品红再加入盐酸,如生成白色沉淀或品红褪色,则说明有NaHSO3生成,否则不存在NaHSO3.
(2)二氧化硫具有还原性,可与酸性高锰酸钾发生氧化还原反应,反应的离子方程式为 5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+,
故答案为:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+;
(3)二氧化硫可与氯气发生氧化还原反应,反应的方程式为SO2+Cl2+2H2O═H2SO4+2HCl,故答案为:还原;SO2+Cl2+2H2O═H2SO4+2HCl;
(4)溶液中的NaOH完全转化为了NaHSO3,二氧化硫应过量,滴加品红褪色,故答案为:品红溶液褪色;
(5)实验探究吸收后产物中是否存在NaHSO3和Na2SO3,可取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液,静置一段时间后,得到滤液A和固体B,往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再滴加盐酸,若品红褪色(或有气泡),则说明含有Na2SO3,然后用试管取少量A,向其中加入过量的氢氧化钡溶液或加入品红再加入盐酸,如生成白色沉淀或品红褪色,则说明有NaHSO3生成,否则不存在NaHSO3,
故答案为:
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液.静置一段时间后,得到滤液A和固体B. | / |
| 滴加盐酸 | 说明含有Na2SO3 |
| 然后用试管取少量A,向其中加入过量的氢氧化钡溶液或加入品红再加入盐酸, | 生成白色沉淀或品红褪色; 说明有NaHSO3生成; 不存在NaHSO3. |

 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,则H2SO4 是否剩余
(2)向反应后的溶液中加入足量的CuO,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4?XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①冷却结晶后要获得较纯净的硫酸铜晶体采取的操作是
②在他们的每一次实验操作中至少称量
③加热法测定该晶体里结晶水X的值,结晶水完全失去的判断方法是
④下面是三次实验数据的平均值
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
(3)装置乙的作用是:
(4)下列说法正确的是:
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3.
(14分)实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如下图所示:
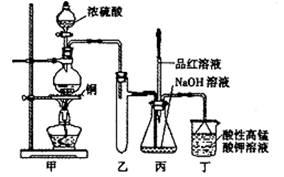
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,有人认为还有一定量的H2SO4剩余,原因是
,在不增加浓H2SO4的前提下,若使剩余铜片溶解可再加入 (填写两种属于不同类别的物质)。
(2)向反应后的溶液中加入足量的CuO,使剩余的H2SO4全部转化为CuSO4,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①在他们的实验操作中至少称量 次。
②下面是其中一次实验的数据
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
根据上表数据计算判断x的实测值比理论值(x=5) (填“偏大”或“偏小”)。
(3)装置乙的作用是: ;
(4)下列说法正确的是: (填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
f.此装置换上其它药品后,不能制取和收集少量纯净的氯气
 实验室用浓硫酸与铜的反应制取少量 NaHSO3,实验装置如图所示.请回答:
实验室用浓硫酸与铜的反应制取少量 NaHSO3,实验装置如图所示.请回答: 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示: