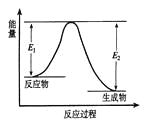
题目内容
【题目】实验室用8.7g的MnO2与50mL足量的浓盐酸制取氯气,其反应方程式为:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)求生成氯气的体积(标准状况)______________
(2)若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度______________。
【答案】2.24L 12mol/L
【解析】
(1)根据化学方程式MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑计算氯气的体积;
MnCl2+2H2O+Cl2↑计算氯气的体积;
(2)根据氯元素守恒计算原浓盐酸的物质的量浓度。
(1)根据实验室制取氯气的方程式:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑,生成氯气的物质的量和消耗MnO2的物质的量相等,n(Cl2)=n(MnO2)=
MnCl2+2H2O+Cl2↑,生成氯气的物质的量和消耗MnO2的物质的量相等,n(Cl2)=n(MnO2)= ![]() =0.1mol,所以生成氯气的体积(标准状况)0.1mol×22.4L/mol=2.24L;
=0.1mol,所以生成氯气的体积(标准状况)0.1mol×22.4L/mol=2.24L;
(2)若向反应后的剩余溶液中加入足量AgNO3溶液,生成氯化银沉淀57.4g,氯化银的物质的量是![]() ,根据氯元素守恒,原浓盐酸中氯化氢的物质的量是0.4mol+0.1mol×2=0.6mol,原浓盐酸的浓度是
,根据氯元素守恒,原浓盐酸中氯化氢的物质的量是0.4mol+0.1mol×2=0.6mol,原浓盐酸的浓度是![]() 12mol/L。
12mol/L。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案【题目】砷(![]() )元素广泛的存在于自然界,在周期表中的位置如表。
)元素广泛的存在于自然界,在周期表中的位置如表。
|
| |
|
| |
|
|
完成下列填空:
(1)砷元素最外层电子的排布式为______________。
(2)砷化镓(![]() )和氮化硼(
)和氮化硼(![]() )晶体都具有空间网状结构,硬度大。砷化镓熔点为1230℃,
)晶体都具有空间网状结构,硬度大。砷化镓熔点为1230℃,![]() 的熔点为3000℃,从物质结构角度解释两者熔点存在差异的原因__________。
的熔点为3000℃,从物质结构角度解释两者熔点存在差异的原因__________。
(3)亚砷酸盐(![]() )在碱性条件下与碘单质反应生成砷酸盐(
)在碱性条件下与碘单质反应生成砷酸盐(![]() ),完成反应的离子方程式: ____
),完成反应的离子方程式: ____![]() +I2+_____ ______。该反应是一个可逆反应,说明氧化还原反应的方向和______有关。
+I2+_____ ______。该反应是一个可逆反应,说明氧化还原反应的方向和______有关。
(4)工业上将含有砷酸盐(![]() )的废水转化为粗
)的废水转化为粗![]() 的工业流程如下:
的工业流程如下:
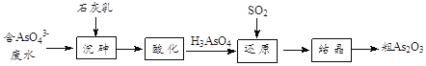
①写出还原过程中砷酸![]() 转化为亚砷酸
转化为亚砷酸![]() 的化学方程式: ___________
的化学方程式: ___________
②“沉砷”是将![]() 转化为
转化为![]() 沉淀,主要反应有:
沉淀,主要反应有:
i.Ca(OH)2(s)Ca2+(aq)+2OH—(aq)+Q
ii.5Ca2++OH—+3![]() Ca5(AsO4)3OH-Q
Ca5(AsO4)3OH-Q
沉砷最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因___。