题目内容
三氯化六氨合钴(Ⅲ)是一种重要的化工产品, 实验中采用H2O2作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂将Co(Ⅱ)氧化为Co(Ⅲ),来制备三氯化六氨合钴(Ⅲ)配合物,反应式为:2CoCl2·6H2O + 10NH3 + 2NH4Cl + H2O2 活性炭2[Co(NH3)6]Cl3 +14H2O
已知:① 钴(Ⅱ)与氯化铵和氨水作用,经氧化后一般可生成三种产物:紫红色的二氯化一氯五氨合钴[Co(NH3)5 Cl]Cl2晶体、砖红色的三氯化五氨一水合钴[Co(NH3)5 H2O]Cl3晶体、橙黄色的三氯化六氨合钴[Co(NH3)6]Cl3晶体,控制不同的条件可得不同的产物(如温度不同产物也不同)。293K时,[Co(NH3)6]Cl3在水中的溶解度为0.26mol/L
②CoCl2、[Co(NH3)6]Cl3、[Co(NH3)5 Cl]Cl2在水中能完全电离
③制备三氯化六氨合钴(Ⅲ)粗产品的流程如下:
④三氯化六氨合钴(Ⅲ)粗产品的提纯流程如下:
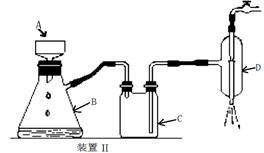
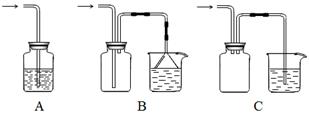
⑤制备过程中可能用到的部分装置如下:

请回答下列问题:
(1)操作B的名称是 ,操作A后所弃去的沉淀中一定有 。
(2)CoCl2在没有铵盐存在的情况下,遇氨水生成蓝色沉淀,该反应的离子方程式为 。原料NH4Cl的主要作用有:① ;②提供NH3。
(3)冷却至10℃后,步骤B中逐滴加入H2O2溶液的目的:① ;②使反应温和进行。
(4)操作A的名称为 ,进行该操作的装置是 (填序号)。
A.装置Ⅰ B.装置Ⅱ C.装置Ⅲ
若操作过程中,发现漏斗尖嘴处有少量晶体析出,处理方法是 。
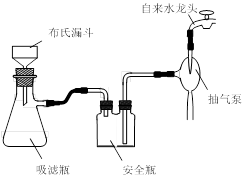
装置Ⅱ中仪器A、B、C、D的名称分别是 、 、 、 。
(5)步骤C进行洗涤时要用到两种试剂,应该先用_____(填序号,下同)洗涤,后用 洗涤。
A. 饱和氯化钠溶液 B. 无水乙醇 C. 浓盐酸
(6)你认为本实验提高产率的关键步骤有哪些? 。
(7)与[Co(NH3)6]Cl3类似的产品还有[Co(NH3)5Cl]Cl2,请简述验证某晶体是[Co(NH3)6]Cl3还是
[Co(NH3)5Cl]Cl2的实验方案: 。
(1)烘干;活性炭 (2)Co2++2NH3·H2O=Co(OH)2↓+ 2NH4+ ;抑制NH3·H2O的电离
(3)避免H2O2的分解 (4)趁热过滤;A;用滤液清洗;布氏漏斗;吸滤瓶;安全瓶;抽气泵
(5)C B (6)①煮沸20min,使反应完全 ②整个过程温度的控制,因为温度不同,产物不同
③最后加入的7mL浓盐酸,因为借助同离子效应使产品析出
(7)取等质量的晶体分别溶于水,室温下加足量的AgNO3溶液后,滤去沉淀,对滤液再进行加热,又能产生沉淀的是[Co(NH3)5 Cl]Cl2,不能再产生沉淀的是[Co(NH3)6 ]Cl3
解析试题分析:(1)抽滤后得到的产品中含有水分,需要烘干,因此操作B的名称是烘干;反应中需要活性炭作催化剂,而活性炭不溶于水,所以操作A后所弃去的沉淀中一定有活性炭。
(2)CoCl2在没有铵盐存在的情况下,遇氨水生成蓝色沉淀,该蓝色沉淀是氢氧化钴,该反应的离子方程式为Co2++2NH3·H2O=Co(OH)2↓+ 2NH4+ ;在碱性条件下容易生成氢氧化钴沉淀,因此原料NH4Cl的主要作用除了提供NH3以外,还有抑制NH3·H2O的电离,降低溶液的碱性。
(3)由于双氧水不稳定,受热易分解,因此冷却至10℃后,步骤B中逐滴加入H2O2溶液的目的是避免H2O2的分解,另外使反应温和进行。
(4)由于温度不同,产物也不同,因此操作A应该是趁热过滤;由于需要保持一定温度,所以选择装置I,即答案选A;若操作过程中,发现漏斗尖嘴处有少量晶体析出,处理方法是用滤液清洗;根据仪器的构造特点可知装置Ⅱ中仪器A、B、C、D的名称分别是布氏漏斗;吸滤瓶;安全瓶;抽气泵。
(5)增大氯离子浓度可以防止产品溶解而损失,因此三氯化六氨合钴首先应该用浓盐酸洗涤,最后再用有机溶剂乙醇洗涤,故答案为C、B。
(6)根据以上分析可知实验提高产率的关键步骤①煮沸20min,使反应完全;②整个过程温度的控制,因为温度不同,产物不同;③最后加入的7mL浓盐酸,因为借助同离子效应使产品析出。
(7)根据结构可知,氯离子作为配体的数目是不同的,且温度不同,产品不同,据此可以验证,即取等质量的晶体分别溶于水,室温下加足量的AgNO3溶液后,滤去沉淀,对滤液再进行加热,又能产生沉淀的是[Co(NH3)5 Cl]Cl2,不能再产生沉淀的是[Co(NH3)6 ]Cl3。
考点:考查物质制备实验方案设计、实验探究与评价等

下列反应适用于实验室制备氧气的是
①高锰酸钾热分解 2KMnO4 K2MnO4+MnO2+ O2↑
K2MnO4+MnO2+ O2↑
②硝酸铵热分解 2NH4NO3 4H2O+2N2↑+ O2↑
4H2O+2N2↑+ O2↑
③过氧化氢催化分解 2H2O2 2H2O +O2↑
2H2O +O2↑
④二氧化氮热分解 2NO2 2NO+ O2↑
2NO+ O2↑
| A.只有① | B.①和② | C.①和③ | D.①③④ |
可用如图所示装置制取、净化、收集的气体是
| A.锌和稀硝酸反应制一氧化氮 |
| B.亚硫酸钠与浓硫酸反应制二氧化硫 |
| C.铁和稀硫酸反应制氢气 |
| D.浓氨水和生石灰反应制取氨气 |


 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
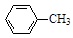 + 2KMnO4
+ 2KMnO4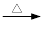
 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O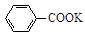 + HCl
+ HCl
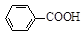 +KCl
+KCl