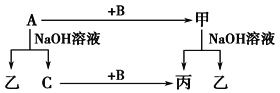
题目内容
【题目】常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,下列对所得溶液的描述不正确的是( )
A.
当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如图变化关系
B.当a=b时,所得溶液中存在:c(OH﹣)+c(CO32﹣)=c(H+)+c(H2CO3)
C.当2a=b时,所得溶液中存在:c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)>c(H+)
D.当 ![]() <a/b<1时,所得溶液中一定存在:c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
<a/b<1时,所得溶液中一定存在:c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
【答案】D
【解析】解:A、n(CO2):n(NaOH)=2bmol:bmol=2>1,所以二者反应生成NaHCO3 , 发生的反应依次为2NaOH+CO2=Na2CO3+H2O、Na2CO3+CO2+H2O=2NaHCO3 , 酸或碱抑制水电离,含有弱离子的盐促进水电离,且CO32﹣水解程度远远大于HCO3﹣ , 溶液中的溶质是NaOH时,抑制水电离,当转化为Na2CO3时促进水电离,再转化为时NaHCO3 , 也促进水电离,但促进水电离程度减小,所以符合图象,故A正确;
B、当a=b时,两者恰好完全反应生成NaHCO3 , 根据NaHCO3溶液中的质子守恒可知:c(OH﹣)+c(CO32﹣)=c(H+)+c(H2CO3),故B正确;
C、当2a=b时,两者恰好完全反应后得Na2CO3溶液,根据Na2CO3在溶液中的行为可知离子浓度大小关系为:c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)>c(H+),故C正确;
D、当 ![]() <
< ![]() <1时,所得溶液为Na2CO3和NaHCO3的混合溶液,根据物料守恒可知在此溶液中c(Na+)与[c(CO32﹣)+c(HCO3﹣)+c(H2CO3)]的比值介于
<1时,所得溶液为Na2CO3和NaHCO3的混合溶液,根据物料守恒可知在此溶液中c(Na+)与[c(CO32﹣)+c(HCO3﹣)+c(H2CO3)]的比值介于 ![]() ~1之间,即不相等,故D错误.
~1之间,即不相等,故D错误.
故选D.

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案