题目内容
【题目】A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
根据图示转化关系回答:
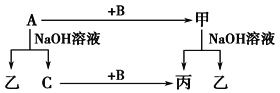
(1)写出下列物质的化学式。
A________,B________,甲_________,乙________。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式________________________________。
②甲与NaOH溶液反应的离子方程式________________________________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。
【答案】 Al O2 Al2O3 NaAlO2 2Al+2NaOH+2H2O===2 NaAlO2+3H2 ↑ Al2O3+2OH-=== 2AlO2-+H2O 0.1mol 0.3mol。
【解析】试题分析:本题考查无机推断,主要考查Al及其化合物的相互转化,化学方程式和离子方程式的书写,化学计算。A是金属单质,A能与NaOH溶液反应,金属单质能与NaOH溶液反应的为Al,则A为Al;Al与NaOH溶液反应生成NaAlO2和H2,C是单质,C为H2,乙为NaAlO2;B是单质,Al+B→甲,甲+NaOH→丙+NaAlO2,H2+B→丙,则B为O2,甲为Al2O3,丙为H2O。
(1)A的化学式为Al,B的化学式为O2,甲的化学式为Al2O3,乙的化学式为NaAlO2。
(2)①Al与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
②Al2O3与NaOH溶液反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,离子方程式为Al2O3+2OH-=2AlO2-+H2O。
(3)n(H2)=![]() =0.15mol,根据反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(Al)=
=0.15mol,根据反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(Al)=![]() n(H2)=
n(H2)=![]() 0.15mol=0.1mol;反应消耗1molAl转移3mol电子,则该反应中转移电子物质的量为0.3mol。
0.15mol=0.1mol;反应消耗1molAl转移3mol电子,则该反应中转移电子物质的量为0.3mol。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案