题目内容
某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,则至少需要称量NaOH固体 g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号) .
Ⅱ.测定中和热的实验装置如图所示
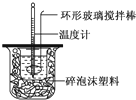
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ?mol-1): .
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如下表.
①请填写下表中的空白:
②根据上述实验数据计算出的中和热为53.5kJ/mol,这与中和热的理论值57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,则至少需要称量NaOH固体
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 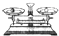 |
 |
 |
 |
 |
 |
| 序号 | a | b | c | d | e | f |

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ?mol-1):
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如下表.
| 温度 实验次数 |
超始温度t1/℃ | 终止温度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②根据上述实验数据计算出的中和热为53.5kJ/mol,这与中和热的理论值57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
考点:中和热的测定,配制一定物质的量浓度的溶液
专题:实验题
分析:Ⅰ、(1)根据公式m=nM=cVM来计算氢氧化钠的质量,但是没有245mL的容量瓶;
(2)氢氧化钠要在玻璃器皿中称量,根据称量固体氢氧化钠所用的仪器来回答;
Ⅱ、(1)根据中和热概念,由中和反应生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
(2)①先根据每1组温度差判断数据的有效性,然后求出温度差平均值;
②a.装置保温、隔热效果差,测得的热量偏小;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小;
(2)氢氧化钠要在玻璃器皿中称量,根据称量固体氢氧化钠所用的仪器来回答;
Ⅱ、(1)根据中和热概念,由中和反应生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
(2)①先根据每1组温度差判断数据的有效性,然后求出温度差平均值;
②a.装置保温、隔热效果差,测得的热量偏小;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小;
解答:
解:Ⅰ、(1)容量瓶没有245mL规格的,只能用250mL规格的,需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g;
故答案为:5.0;
(2)氢氧化钠要在小烧杯中称量,称量固体氢氧化钠所用的仪器有天平、烧杯和药匙;
故答案为:abe;
Ⅱ、(1)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀硫酸和氢氧化钡钠稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为:
H2SO4(aq)+NaOH(aq)=
Na2SO4(aq)+2H2O(l)△H=-57.3kJ/mol,
故答案为:
H2SO4(aq)+NaOH(aq)=
Na2SO4(aq)+2H2O(l)△H=-57.3kJ/mol;
(2)①4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第2组数据舍去,温度差平均值=
=
=4.0℃,
②a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失,中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,中和热的数值偏小,故d正确.
故答案为:acd.
故答案为:5.0;
(2)氢氧化钠要在小烧杯中称量,称量固体氢氧化钠所用的仪器有天平、烧杯和药匙;
故答案为:abe;
Ⅱ、(1)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀硫酸和氢氧化钡钠稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为:
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
(2)①4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第2组数据舍去,温度差平均值=
| 3次实验中(终止温度-初始温度)的和 |
| 3 |
| 4.0℃+3.9℃+4.1℃, |
| 3 |
②a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失,中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,中和热的数值偏小,故d正确.
故答案为:acd.
点评:本题主要考查热化学方程式以及反应热的计算,题目难度大,注意理解中和热的概念、把握热化学方程式的书写方法,以及测定反应热的误差等问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组化合物的晶体都属于分子晶体的是( )
| A、H2O,O3,NaCl |
| B、CCl4,(NH4)2S,H2O2 |
| C、SO2,SiO2,CS2 |
| D、P2O5,CO2,H3PO4 |
 实验室用乙醇和浓硫酸加热反应制取乙烯,其原理为:
实验室用乙醇和浓硫酸加热反应制取乙烯,其原理为: 已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化
已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化 按要求完成下列两题:
按要求完成下列两题: