题目内容
已知某温度下氢氰酸(HCN)的电离平衡常数是6.4×10-10(mol/L)2。请计算:
(1)常温下,1 mol/L的氢氰酸溶液中H+浓度及PH。
(2)在该酸溶液中由水电离产生的氢氧根离子的浓度。
(1)常温下,1 mol/L的氢氰酸溶液中H+浓度及PH。
(2)在该酸溶液中由水电离产生的氢氧根离子的浓度。
⑴2.5× mol/L 4.6;⑵4×
mol/L 4.6;⑵4× mol/L。
mol/L。
 mol/L 4.6;⑵4×
mol/L 4.6;⑵4× mol/L。
mol/L。本题考查有关电离平衡常数的简单计算,应依据电离方程式HCN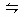 H++ CN-推知HCN分子、CN-和H+的平衡浓度。设氢氰酸(HCN)的电离达到平衡时H+的浓度为x,则: HCN
H++ CN-推知HCN分子、CN-和H+的平衡浓度。设氢氰酸(HCN)的电离达到平衡时H+的浓度为x,则: HCN 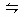 H+ + CN-
H+ + CN-
初始浓度/mol/L: 1 0 0
转化浓度/mol/L: x x x
平衡浓度/mol/L: 1—x x x
依题意,可得:Ka= =
= ≈
≈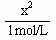
解之,得:x=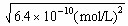 =2.5×
=2.5× mol/L
mol/L
即:[H+]=2.5× mol/L,则:PH=-lg(2.5×
mol/L,则:PH=-lg(2.5× )=5-0.4=4.6
)=5-0.4=4.6
[OH-]=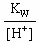 =
= =4×
=4× mol/L
mol/L
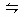 H++ CN-推知HCN分子、CN-和H+的平衡浓度。设氢氰酸(HCN)的电离达到平衡时H+的浓度为x,则: HCN
H++ CN-推知HCN分子、CN-和H+的平衡浓度。设氢氰酸(HCN)的电离达到平衡时H+的浓度为x,则: HCN 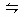 H+ + CN-
H+ + CN-初始浓度/mol/L: 1 0 0
转化浓度/mol/L: x x x
平衡浓度/mol/L: 1—x x x
依题意,可得:Ka=
 =
= ≈
≈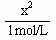
解之,得:x=
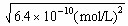 =2.5×
=2.5× mol/L
mol/L即:[H+]=2.5×
 mol/L,则:PH=-lg(2.5×
mol/L,则:PH=-lg(2.5× )=5-0.4=4.6
)=5-0.4=4.6[OH-]=
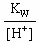 =
= =4×
=4× mol/L
mol/L
练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
 ,不正确的是
,不正确的是