题目内容
【题目】把NaHCO3和Na2CO3 .10H2O混合6.56克溶于水,制成100ml溶液,其中Na+物质的量浓度为0.5mol/L ,若将等质量的该混合物加热至恒重,所得固体质量为 ( )
A. 2.65 g B. 3.91 g C. 5.3 g D. 4.23g
【答案】A
【解析】
试题混合物加热至恒重,所得固体为碳酸钠,Na+的物质的量为0.5mol/L ×0.1L="0.05mol" ,所以碳酸钠的物质的量为0.025mol,质量为2.65g,故A项正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】阅读分析下列材料:
材料1:纯碱和氯化钠溶解度随温度变化的曲线图: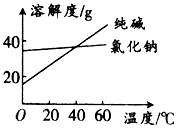
材料2:两种有机物的物理性质:
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
乙二醇 | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇及其他有机溶剂 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水和酒精以任意比互溶;易溶于其他有机溶剂 |
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,合适的方法是(填字母,下同);将乙二醇和丙三醇混合液相互分离的最佳方法是: .
A、萃取 B、蒸馏 C、溶解、蒸发浓缩、冷却结晶、过滤 D、分液
(2)某纯碱样品中可能含有氯化钠,设计一个简易实验加以证明: . (写出简要操作方法、现象和结论)
(3)某同学设计两套方案测定纯碱样品(含少量的氯化钠)中碳酸钠的质量分数.
方案1:取mg纯碱样品,加入过量的盐酸,充分反应后,蒸发、灼烧、称重得bg固体,计算出纯碱样品纯度.
方案2:取mg纯碱样品,溶于水加入过量的氯化钙溶液,过滤、洗涤、烘干、称重得ag固体,计算出纯碱样品纯度.
①写出方案1涉及的反应的化学方程式:;
②利用方案2中的数据计算该纯碱的纯度: .
