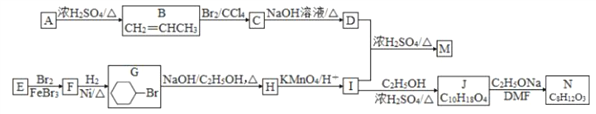
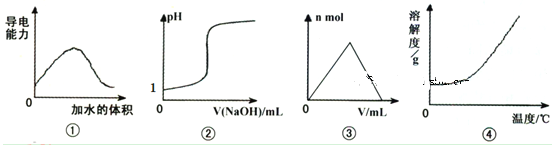
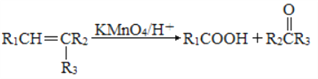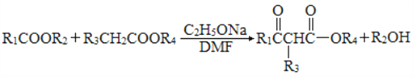题目内容
【题目】下列说法正确的是
①物质燃烧一定是放热反应②需要加热才能发生的反应一定是吸热反应③放热的化学反应不需要加热就能发生④反应是放出能量还是吸收能量取决于反应物和生成物所具有的总能量的相对大小
A. ③④ B. ①④ C. ②④ D. ②③
【答案】B
【解析】①可燃物燃烧均为放热反应,故①正确;②放热反应有的需加热,有的不需加热,如铝热反应是放热反应,但需要加热,故②错误;③有的放热反应需要高温条件发生,如铝热反应是放热反应,但需要加热,故③错误;④反应物所具有的总能量高于生成的总能量,则反应为放热反应;反应物所具有的总能量低于生成的总能量,则反应为吸热反应,故④正确;②④正确,答案为B。

 能考试期末冲刺卷系列答案
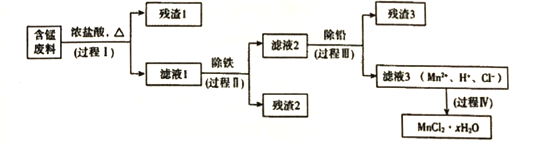
能考试期末冲刺卷系列答案【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:
资料a: Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b:生成氢氧化物沉淀的pH见下表(金属离子的起始浓度为0.1 mol·L-1)
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
(1)过程I的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnO2与浓盐酸反应的离子方程式是__________________________________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入黄色K3[Fe(CN)6](铁氰化钾)溶液,无明显变化:另取少量滤液1于试管中,___________________________。
③Fe3+由Fe2+转化而成,可能发生的反应有:i.2Fe2++Cl2=2Fe3++2Cl-
ii.4Fe2++O2+4H+=4Fe3++2H2O iii.……
写出iii的离子方程式:___________________________。
(2)过程II的目的是除铁,有如下两种方法:
i.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ii.焙烧法:将滤液1浓缩得到的固体于290°C焙烧,冷却,取焙烧物……
己知:焙烧中发生的主要反应2FeCl3+3O2=2Fe2O3+3Cl2,焙烧时MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在 _______________之间。
②补全ii中的操作:____________________。
③两种方法比较,氨水法除铁的缺点是_________________________________________。
(3)过程III的目的是除铅。加入的试剂是______________________。
(4)过程IV所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g。则x=________________________。