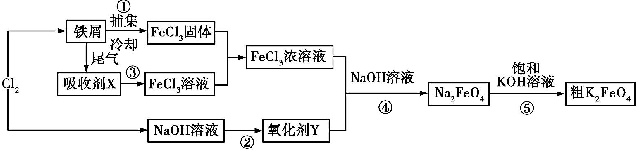
题目内容
14.一定量的铁粉和250mL某浓度的硝酸溶液发生反应,图示如下: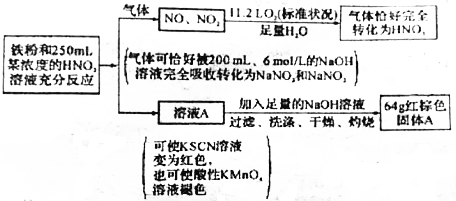
根据上述信息,回答下列相关问题:
(1)充分反应后,硝酸无(填“有”或“无”)剩余;投入的铁粉质量为44.8g.
(2)原硝酸溶液中c(HNO3)=12.8mol/L.
(3)生成的气体中,NO与NO2的体积比为1:2(不考虑NO2与N2O4的相互转化).
(4)本题中,铁粉和硝酸总反应的化学方程式为:2Fe+8HNO3=Fe(NO3)3+Fe(NO3)2+NO↑+2NO2↑+4H2O.
(5)将含有1mol溶质的硫酸溶液加入到溶液A中,然后加水稀释到500mL,此时所得溶液最多可溶解金属铜的质量是60.8g.
分析 一定量的铁粉和250mL某浓度的硝酸溶液反应,生成NO、NO2气体,气体与11.2L氧气、足量的水反应恰好得到硝酸,纵观整个过程Fe失去电子等于氧气获得电子,即Fe与硝酸反应中转移电子为$\frac{11.2L}{22.4L/mol}$×4=2mol,而气体恰好为200mL、6mol/L的NaOH溶液完全吸收转化为NaNO2、NaNO3,由Na元素、N元素守恒可知n(NO)+n(NO2)=n(NaOH)=0.2L×6mol/L=1.2mol,结合转移电子守恒:3n(NO)+n(NO2)=2,联立方程可得:n(NO)=0.4,n(NO2)=0.8;
溶液A可以使KSCN溶液变红色,说明含有Fe3+,也可以使酸性高锰酸钾溶液褪色,说明含有Fe2+,反应生成
Fe(NO3)3,Fe(NO3)2,则反应中HNO3没有剩余,溶液A中加入足量的NaOH溶液,过滤、洗涤、干燥、灼烧,最终得到64g红棕色固体为Fe2O3,根据Fe元素守恒可知n(Fe)=2n(Fe2O3)=2×$\frac{64g}{160g/mol}$=0.8mol,根据电子转移:3n(Fe3+)+2n(Fe2+)=2mol,联立可得n(Fe3+)=0.4,n(Fe2+)=0.4mol,据此解答.
解答 解:一定量的铁粉和250mL某浓度的硝酸溶液反应,生成NO、NO2气体,气体与11.2L氧气、足量的水反应恰好得到硝酸,纵观整个过程Fe失去电子等于氧气获得电子,即Fe与硝酸反应中转移电子为$\frac{11.2L}{22.4L/mol}$×4=2mol,而气体恰好为200mL、6mol/L的NaOH溶液完全吸收转化为NaNO2、NaNO3,由Na元素、N元素守恒可知n(NO)+n(NO2)=n(NaOH)=0.2L×6mol/L=1.2mol,结合转移电子守恒:3n(NO)+n(NO2)=2,联立方程可得:n(NO)=0.4,n(NO2)=0.8;
溶液A可以使KSCN溶液变红色,说明含有Fe3+,也可以使酸性高锰酸钾溶液褪色,说明含有Fe2+,反应生成
Fe(NO3)3,Fe(NO3)2,则反应中HNO3没有剩余,溶液A中加入足量的NaOH溶液,过滤、洗涤、干燥、灼烧,最终得到64g红棕色固体为Fe2O3,根据Fe元素守恒可知n(Fe)=2n(Fe2O3)=2×$\frac{64g}{160g/mol}$=0.8mol,根据电子转移:3n(Fe3+)+2n(Fe2+)=2mol,联立可得n(Fe3+)=0.4,n(Fe2+)=0.4mol.
(1)由上述分析可知,充分反应后,硝酸无剩余;投入的铁粉质量为0.8mol×56g/mol=44.8g,
故答案为:无;44.8;
(2)根据N元素守恒,n(HNO3)=3n[(Fe(NO3)3]+2n[Fe(NO3)2]+n(NO)+n(NO2)=0.4mol×3+0.4mol×2+1.2mol=3.2mol,原硝酸溶液中c(HNO3)=$\frac{3.2mol}{0.25L}$=12.8mol/L,
故答案为:12.8mol/L;
(3)生成的气体中,NO与NO2的体积比为0.4mol:0.8mol=1:2,
故答案为:1:2;
(4)生成Fe(NO3)3、Fe(NO3)2、NO、NO2的物质的量之比为1:1:1:2,本题中铁粉和硝酸总反应的化学方程式为:2Fe+8HNO3=Fe(NO3)3+Fe(NO3)2+NO↑+2NO2↑+4H2O,
故答案为:2Fe+8HNO3=Fe(NO3)3+Fe(NO3)2+NO↑+2NO2↑+4H2O;
(5)将含有1mol溶质的硫酸溶液加入到溶液A中,然后加水稀释到500mL,溶液中n(Fe2+)=0.4mol、n(H+)=2mol、n(NO3-)=0.4mol×3+0.4mol×2=2mol,
3 Fe2++4H++NO3-=3 Fe3++NO↑+2H2O
0.4mol $\frac{1.6}{3}$mol $\frac{0.4}{3}$mol 0.4mol
剩余n(NO3-)=2mol-$\frac{0.4}{3}$mol=$\frac{5.6}{3}$mol,剩余n(H+)=2mol-$\frac{1.6}{3}$mol=$\frac{4.4}{3}$mol,
由 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,可知H+不足,故可以溶解Cu为$\frac{4.4}{3}$mol×$\frac{3}{8}$=0.55mol,
反应后溶液中n(Fe3+)=0.8mol,由2Fe3++Cu=2 Fe2++Cu2+,可知溶解Cu为0.4mol,
故最多溶解Cu为(0.55mol+0.4mol)×64g/mol=60.8g,
故答案为:60.8g.
点评 本题考查混合物计算,注意利用守恒进行解答,(5)为易错点、难点,较好的考查是分析计算能力,难度较大.

 步步高达标卷系列答案
步步高达标卷系列答案| A. | 标准状况下,HF为液态,是因为氢氟键很稳定 | |
| B. | N最外层有5个电子,所以负化合价只有-3价 | |
| C. | 硅和锗处于金属与非金属的过渡位置,硅和锗都可用作半导体材料 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
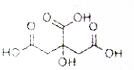 物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价整合剂,也是化学中间体.下列关于物质X的说法正确的是( )
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价整合剂,也是化学中间体.下列关于物质X的说法正确的是( )| A. | X分子式C6H7O7 | |
| B. | 1mol物质X可以和3mol氢气发生加成 | |
| C. | X可以发生氧化反应、取代反应和消去反应 | |
| D. | 1molX分别与足量的NaHCO3、Na反应得到的气体体积比为3:2 |
 离子交换膜法电解食盐水的示意如图,图中离子交换膜只允许阳离子通过.下列说法正确的是( )
离子交换膜法电解食盐水的示意如图,图中离子交换膜只允许阳离子通过.下列说法正确的是( )| A. | e电极与电源的负极相连 | |
| B. | H+在f电极上发生还原反应 | |
| C. | 精制饱和食盐水从图中b位置补充 | |
| D. | 离子交换膜的作用只是防止生成的Cl2与H2发生反应 |